
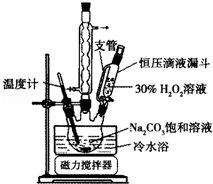
 2Na2CO3•3H2O2是一種新型的氧系漂白劑.某實驗興趣小組進行了如下實驗.
2Na2CO3•3H2O2是一種新型的氧系漂白劑.某實驗興趣小組進行了如下實驗.分析 Ⅰ.(1)球形冷凝管可使液體冷凝回流;冷水浴降低溫度,防止物質分解;
(2)加入適量NaCl固體,發生鹽析;
(3)2Na2CO3•3H2O2極易分解,生成碳酸鈉、氧氣、水;
Ⅱ.(4)高錳酸鉀標準溶液為紫色,與過氧化氫發生氧化還原反應;活性氧含量計算公式:Q%=$\frac{40cV}{m}$×100%,以此計算;
Ⅲ.(5)方案中可測定過氧化氫分解生成的氧氣,或測定碳酸根離子轉化生成的沉淀或氣體來測定產品中2Na2CO3•3H2O2的質量分數.
解答 解:Ⅰ.(1)裝置中球形冷凝管的作用是起冷凝回流的作用,過氧化氫不穩定,則使用冷水浴的作用是防止溫度過高,H2O2分解,
故答案為:起冷凝回流的作用,防止溫度過高,H2O2分解;
(2)加入適量NaCl固體,降低產品的溶解度(鹽析作用)或便于析出晶體,故答案為:降低產品的溶解度(鹽析作用)或便于析出晶體;
(3)2Na2CO3•3H2O2極易分解,生成碳酸鈉、氧氣、水,反應方程式為2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑,
故答案為:2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑;
Ⅱ.(4)高錳酸鉀標準溶液為紫色,能與過氧化氫發生氧化還原反應,高錳酸鉀標準溶液滴定2Na2CO3•3H2O2,則滴定終點的判斷依據為溶液由無色呈紫色且30s內不褪色,0.0200mol/L高錳酸鉀標準溶液消耗的體積為32.70mL,試樣0.2000g,活性氧含量為Q%=$\frac{40cV}{m}$×100%=$\frac{40×0.020mol/L×0.03270L}{0.200g}$×100%=13.08%,
故答案為:溶液由無色呈紫色且30s內不褪色,13.08%;
Ⅲ.(5)方案中可測定過氧化氫分解生成的氧氣,或測定碳酸根離子轉化生成的沉淀(或氣體體積)質量測定產品中2Na2CO3•3H2O2的質量分數,則方案二為將試樣與足量的氯化鋇(或氯化鈣等)溶液反應后,過濾,干燥所得沉淀,稱量沉淀的質量(或試樣與足量稀硫酸反應后,經除雜干燥后,測二氧化碳的體積,進行計算),
故答案為:將試樣與足量的氯化鋇(或氯化鈣等)溶液反應后,過濾,干燥所得沉淀,稱量沉淀的質量(或試樣與足量稀硫酸反應后,經除雜干燥后,測二氧化碳的體積,進行計算).
點評 本題考查制備實驗方案的設計,為高頻考點,把握實驗基本操作、實驗技能及測定原理、發生的反應等為解答的關鍵,側重分析與實驗能力的考查,題目難度中等.


 輕松暑假總復習系列答案
輕松暑假總復習系列答案科目:高中化學 來源: 題型:解答題
| 陽離子 | Na+、Ba2+、NH4+ |
| 陰離子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,則中和熱為a/2kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l);△H1=-akJ•mol-1,則氫氣燃燒熱為akJ•mol-1 | |
| C. | 反應物的總能量低于生成物的總能量時,該反應必須加熱才能發生 | |
| D. | N2(g)+3H2(g)?2NH3(g);△H=-akJ•mol-1,則將14gN2(g)和足量H2置于一密閉容器中,充分反應后放出0.5akJ的熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 綠色化學的核心是應用化學原理對環境污染進行治理 | |
| B. | 石英可用于制作光導纖維,光導纖維遇強堿會“斷路” | |
| C. | 清晨陽光穿過林木枝葉鋪灑地面屬于丁達爾現象 | |
| D. | 高鐵車廂大部分材料采用鋁合金,因鋁合金強度大、質量輕、抗腐蝕能力強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某H2S04溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×l0-8,由水電離出的c(H+)=1×10-11 mol•L-1 | |
| B. | 將0.02 mol.L-1 HCI溶液與0.02 mol•L-l Ba( OH)2溶液等體積混合后,溶液pH約為12 | |
| C. | 將一定體積稀鹽酸與稀氨水混合,當溶質為NH3•H20和NH4Cl時,溶液的pH≥7 | |
| D. | 向0.1 mol•L-1 Na2C03溶液中逐滴滴加0.1 mol•L-1稀鹽酸,溶液中c(HCO3-)先增大后減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4+、SO42-、CO32-、K+ | B. | Na+、Ba2+、Ca2+、HCO3- | ||
| C. | Mg2+、Ag+、K+、Cl- | D. | K+、Cl-、Na+、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 圖是2008年北京奧運會的“祥云”火炬,與悉尼奧運火炬所用主要燃料(丁烷)不同,“祥云”火炬所用燃料為丙烷.丙烷和丁烷的沸點如下表:
圖是2008年北京奧運會的“祥云”火炬,與悉尼奧運火炬所用主要燃料(丁烷)不同,“祥云”火炬所用燃料為丙烷.丙烷和丁烷的沸點如下表:| 丙烷 | 丁烷 | |
| 沸點/℃ | -42.6 | -0.5 |
| A. | 丙烷燃燒生成的產物無害,是環保型燃料 | |
| B. | 丙烷的沸點比丁烷低,是因為分子間作用力比丁烷弱 | |
| C. | 丙烷在低溫時保持的壓力比丁烷大 | |
| D. | 丙烷和丁烷都不存在同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡氣體總濃度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com