
在25 ℃時,用蒸餾水稀釋1 mol·L-1氨水至0.01 mol·L-1,隨溶液的稀釋,下列各項中始終保持增大趨勢的是( )
A.c(NH4+)/c(OH-) B.c(OH-)/c(NH3·H2O)
C.c(NH3·H2O)/c(NH4+) D.OH-物質的量
科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 滴定次數 | 標準溶液體積/mL | 待測溶液體積/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20.00 | 1.50 | 23.70 |
| 2 | 20.00 | 1.02 | 21.03 |
| 3 | 20.00 | 2.00 | 21.99 |
| 編號 | 溫度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色時間/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另外加少量MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
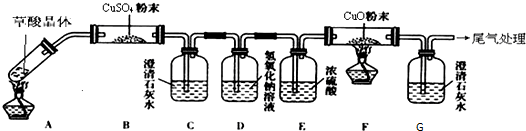
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 實驗編號 | V(燒堿溶液)/mL | V(HCl)/mL | |
| 初讀數 | 末讀數 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com