
| A. | 反應后溶液中H+剩余 1.8mol | |
| B. | 由于氧化性Fe3+>H+,故反應中先沒有氣體產生后產生氣體 | |
| C. | 反應后產生13.44L H2(標準狀況) | |
| D. | 反應后溶液中Fe2+和Fe3+物質的量之和為0.9mol |
分析 Fe(NO3)3和H2SO4的物質的量分別為0.2mol、1.5mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,氧化性為HNO3>Fe3+>H+,先發生Fe+4H++NO3-═Fe3++NO↑+2H2O、再發生Fe+2Fe3+═3Fe2+,若還有Fe剩余,則最后發生Fe與氫離子的反應,以此來解答.
解答 解:Fe(NO3)3和H2SO4的物質的量分別為0.2mol、1.5mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,氧化性為HNO3>Fe3+>H+,則
Fe+4H++NO3-═Fe3++NO↑+2H2O
1 4 1 1
0.6 2.4 0.6 0.6
Fe+2Fe3+═3Fe2+,
1 2 3
0.1 0.2 0.3
Fe完全反應,沒有剩余,溶液中存在0.6molFe3+、0.3molFe2+、
A.反應后溶液中H+剩余1.5mol×2-2.4mol=0.6mol,故A錯誤;
B.氧化性為HNO3>Fe3+>H+,先發生Fe+4H++NO3-═Fe3++NO↑+2H2O,有氣體生成,故B錯誤;
C.不發生Fe+2H+═Fe2++H2↑,沒有氫氣生成,故C錯誤;
D.反應后溶液中存在0.6molFe3+、0.3molFe2+,反應后溶液中Fe2+和Fe3+物質的量之和為0.9mol,故D正確;
故選D.
點評 本題考查鐵的化學性質及化學反應的計算,明確發生的化學反應及反應的先后是解答本題的關鍵,注意過量計算來解答,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | pH=3的HNO3與pH=11的KOH溶液 | |
| B. | pH=3的HNO3與pH=11的氨水 | |
| C. | pH=3的H2SO4與pH=11的NaOH | |
| D. | pH=3的CH3COOH 與pH=11的Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
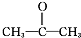 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
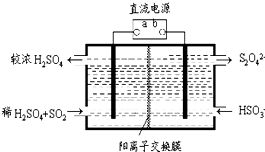 氮和硫的氧化物有多種,其中SO2和NOx都是大氣污染物,對它們的研究有助于空氣的凈化.
氮和硫的氧化物有多種,其中SO2和NOx都是大氣污染物,對它們的研究有助于空氣的凈化.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
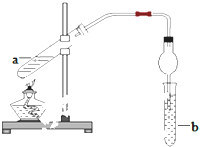 如圖,在試管a中先加入2mL95%的乙醇,再加入3mL無水醋酸,邊搖邊緩緩加入2mL濃H2SO4,用玻璃棒充分攪拌后將試管固定在鐵架臺上,在試管b中加入5mL飽和碳酸鈉溶液.連接好裝置.用酒精燈對試管a加熱,當觀察到試管b中有明顯現象時停止實驗.
如圖,在試管a中先加入2mL95%的乙醇,再加入3mL無水醋酸,邊搖邊緩緩加入2mL濃H2SO4,用玻璃棒充分攪拌后將試管固定在鐵架臺上,在試管b中加入5mL飽和碳酸鈉溶液.連接好裝置.用酒精燈對試管a加熱,當觀察到試管b中有明顯現象時停止實驗. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | 孤對電子對數 | 軌道雜化形式 | 分子或離子的空間構形 |
| SO3 | 0 | sp2雜化 | 平面三角形 |
| PO43- | 0 | sp3雜化 | 正四面體 |
| NCl3 | 1 | sp3雜化 | 三角錐形 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗步驟 | 向3-4mL 1mol/L AgNO3溶液中滴入1mol/L的Na2SO4溶液至反應完全. |
| 實驗現象 | ①產生白色沉淀 |
| 離子方程式 | 2Ag++SO${\;}_{4}^{2-}$=Ag2SO4 |
| 小組討論交流 | 取上述反應后的清液于試管中滴入適量1mol/L的NaCl 溶液,對于會出現的現象提出了假設 |
| 提出假設 | 假設Ⅰ:反應沒有限度 假設Ⅱ:②無現象 |
| 證明假設Ⅱ | 現象③:產生白色沉淀;理由④反應存在限度,溶液中尚有較多Ag+ |
| 離子方程式 | ⑤Ag++Cl-=AgCl↓ |
| 解釋 | ⑥加入Cl-產生了大量的白色沉淀,說明Ag++Cl- AgCl↓反應是可逆反應,存在反應限度,所以Ag+不能反應完,才出現這種現象 AgCl↓反應是可逆反應,存在反應限度,所以Ag+不能反應完,才出現這種現象 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com