
分析 11.5g N2O4氣體物質的量=$\frac{11.5g}{92g/mol}$=0.125mol,
(1)由N2O4?2NO2,反應進行到2s時,NO2含量為0.01mol,則N2O4減少0.005mol,結合v=$\frac{△c}{△t}$計算反應速率;
(2)60s時達到平衡,此時容器內混合氣體密度是氫氣密度的28.75倍,則混合氣體的平均摩爾質量為28.75×2=57.5g/mol,
N2O4?2NO2,
開始0.125 0
轉化 x 2x
平衡0.125-x 2x
則:$\frac{92g/mol×(0.125mol-x)mol+46g/nol×2xmol}{0.125mol-x+2x}$=57.5g/mol,
解得x=0.075mol,根據壓強之比等于物質的量之比計算;
(3)根據(2)可知平衡時體系中N2O4的物質的量;
(4)根據轉化率=$\frac{反應消耗的物質的量}{反應前總物質的量}$×100%計算.
解答 解:11.5g N2O4氣體物質的量=$\frac{11.5g}{92g/mol}$=0.125mol,
(1)由N2O4?2NO2,反應進行到2s時,NO2含量為0.01mol,則N2O4減少0.005mol,由v=$\frac{\frac{0.005\\;mol}{0.5L}}{2s}$=0.005 mol•L-1•s-1,
答:開始2s內以N2O4表示的反應速率為0.005 mol•L-1•s-1;
(2)60s時達到平衡,此時容器內混合氣體密度是氫氣密度的28.75倍,則混合氣體的平均摩爾質量為28.75×2=57.5g/mol,
N2O4 ?2NO2,
開始(mol)0.125 0
轉化(mol) x 2x
平衡(mol)0.125-x 2x
則$\frac{92g/mol×(0.125mol-x)mol+46g/nol×2xmol}{0.125mol-x+2x}$=57.5g/mol,
解得:x=0.075mol,
開始總物質的量為0.125mol,平衡時總物質的量為0.125+0.075=0.2mol,
由壓強之比等于物質的量之比可知,達平衡時體系的壓強是開始時的$\frac{0.2mol}{0.125mol}$=1.6倍,
答:達平衡時體系的壓強是開始時的1.6倍;
(3)由(2)的計算可知,達到平衡時,體系中N2O4的物質的量為:0.125mol-0.075mol=0.05mol,
答:達到平衡時,體系中N2O4的物質的量為0.05mol;
(4)則N2O4的平衡轉化率為:$\frac{0.075mol}{0.125mol}$×100%=60%,
答:N2O4的平衡轉化率為60%.
點評 本題考查化學平衡及化學反應速率的計算,題目難度中等,明確信息中的平均摩爾質量的計算是解答的關鍵,并熟悉化學反應速率的計算式及化學平衡三段法計算即可解答.


科目:高中化學 來源: 題型:選擇題
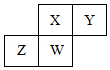 短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示,其中W原子的質子數是其最外層電子數的三倍,下列說法不正確的是( )
短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示,其中W原子的質子數是其最外層電子數的三倍,下列說法不正確的是( )| A. | 最簡單氣態氫化物的熱穩定性:Y>X>W>Z | |
| B. | 最高價氧化物對應的水化物的酸性:X>W>Z | |
| C. | 原子半徑:W>Z>Y>X | |
| D. | 元素X、Z、W的最高正價分別與其主族序數相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸式鹽的水溶液一定顯酸性 | |
| B. | 只要酸與堿的物質的量濃度和體積分別相等,它們反應后的溶液就呈中性 | |
| C. | 純水呈中性是因為水中c(H+)和c(OH-)相等 | |
| D. | NaHCO3與Na2SO4溶液的混合溶液呈中性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學反應 | 反應熱 | 平衡常數(850℃) |
| ①CO (g)+2H2 (g)═CH3 OH(g) | △H1=-90.8kj/mol | k1=160(mol/L)-2 |
| ②CO2 (g)+H2 (g)═CO (g)+H2 O(g) | △H2=-41.2kj/mol | K2 |
| ③3H2 (g)+CO2 (g)═H2 O(g)+CH3 OH(g)△H 3 | △H3 | K3=160(mol/L)-2 |
| 物質 | H2 | CO2 | CH3OH | H2O |
| 濃度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |
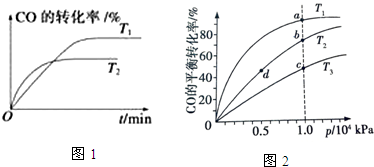
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
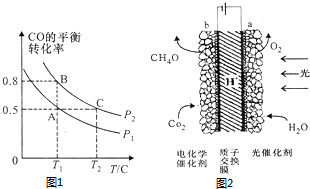
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com