
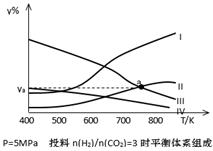
以CO2為碳源制取低碳有機物成為國際研究焦點,下面為CO2加氫制取低碳醇的熱力學數據:
反應Ⅰ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
反應Ⅱ:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
(1)寫出由CH3OH(g)合成CH3CH2OH(g)的熱化學反應方程式:
(2)對反應Ⅰ,在一定溫度下反應達到平衡的標志是 (選填編號)
a.反應物不再轉化為生成物 b.平衡常數K不再增大
c.CO2的轉化率不再增大 d.混合氣體的平均相對分子質量不再改變
(3)在密閉容器中,反應Ⅰ在一定條件達到平衡后,其它條件恒定,能提高CO2轉化率的措施是 (選填編號)
| A.降低溫度 | B.補充CO2 | C.加入催化劑 | D.移去甲醇 |
(1)2CH3OH(g)  CH3CH2OH(g) +H2O(g) ?H = —75.6 kJ·mol-1(3分)
CH3CH2OH(g) +H2O(g) ?H = —75.6 kJ·mol-1(3分)
(2)cd(2分)
(3)AD(2分)
(4) Ⅳ(2分) 18.8(3分)
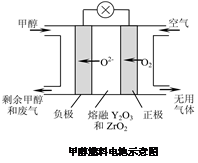
(5)CH3OH-6e-+3O2-=CO2↑+2H2O(3分)
解析試題分析:(1)根據蓋斯定律,將反應Ⅰ×2,然后用反應Ⅱ減去反應Ⅰ×2即得所求方程式。所以由CH3OH(g)合成CH3CH2OH(g)的熱化學反應方程式2CH3OH(g)  CH3CH2OH(g) +H2O(g) ?H = —75.6 kJ·mol-1
CH3CH2OH(g) +H2O(g) ?H = —75.6 kJ·mol-1
(2)a、化學平衡是動態平衡,反應一直進行,錯誤;b、溫度不變,化學平衡常數不變,所以一定溫度下的平衡常數一直不變,錯誤;c、反應開始時二氧化碳的轉化率一直升高,達平衡時轉化率不再升高,正確;d、該反應是反應前后氣體的物質的量改變的可逆反應,氣體總質量不變,所以混合氣體的平均相對分子質量一直在變化,達平衡時不再變化,正確,答案選cd。
(3)提高CO2轉化率也就是使平衡正向移動,A、降溫,平衡向放熱反應方向移動,正反應為放熱反應,所以平衡正向移動,正確;B、補充二氧化碳只能提高氫氣的轉化率,本身的轉化率降低,錯誤;C、加入催化劑對平衡無影響,錯誤;D、移走甲醇,使生成物濃度減小,平衡正向移動,正確,答案選AD。
(4)升高溫度,平衡逆向移動,二氧化碳與氫氣的含量增大,乙醇與水的含量減小,反應開始時按H2與CO2的物質的量之比為3:1進行投料,所以生成的乙醇與水的物質的量比仍為1:3,即水的含量是乙醇含量的3倍,所以表示CH3CH2OH組分的曲線是Ⅳ;曲線曲線Ⅱ和Ⅲ分別代表二氧化碳、水,當二者的體積分數相同時,體積也相同,設它們的體積都是V,根據投料比,氫氣的體積是二氧化碳的3倍為3V,乙醇的體積是水的1/3,即1/3V,所以總體積是V+V+3V+1/3V=16V/3,則a點對應的體積分數ya=V/16V/3×100%=18.75%;保留3位有效數字是18.8%。
(5)甲醇燃料電池中在負極發生氧化反應的是甲醇,結合正極產生的氧負離子生成二氧化碳和水,電極反應式CH3OH-6e-+3O2-=CO2↑+2H2O
考點:考查蓋斯定律的應用,化學平衡的判斷及勒夏特列原理的應用,圖像的分析,體積分數的計算,電化學理論的應用


 通城學典默寫能手系列答案
通城學典默寫能手系列答案 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:填空題
(8分) 關于反應熱請回答如下問題:
(1)向1L1mol/L的NaOH溶液中加入下列物質:①濃H2SO4;②稀硝酸;③稀醋酸,恰好完全反應的熱效應為△H1、△H2、△H3,則三者由小到大順序為 。
(2) 實驗測得,向200mL1mol/L的NaOH溶液中加入稀醋酸恰好反應放出Q kJ的熱量,請寫出熱化學反應方程式:_________________________ 。
(3)已知反應CH3—CH3(g)―→CH2=CH2(g)+H2(g),有關化學鍵的鍵能如下。
| 化學鍵 | C—H | C=C | C—C | H—H |
| 鍵能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
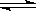 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14分)2013年10月我市因臺風菲特遭受到重大損失,市疾控中心緊急采購消毒藥品,以滿足災后需要。復方過氧化氫消毒劑具有高效、環保、無刺激無殘留,其主要成分H2O2是一種無色粘稠液體,請回答下列問題:
⑴火箭發射常以液態肼(N2H4)為燃料,液態H2O2為助燃劑。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H="-" 534 kJ·mol-1 ①
H2O2(1)=H2O(1)+1/2O2(g) △H="-" 98.64 kJ·mol-1 ②
H2O(1)=H2O(g) △H=+44kJ·mol-l ③
則反應N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H= ,
⑵據報道,以硼氫化合物NaBH4(B元素的化合價為+3價)和H2O2作 原料的燃 料電池,負極材料采用Pt/C,正極材料采用MnO2,可用作空軍通信衛星電,其工作原理如圖所示。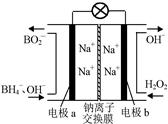
則該電池的正極反應____ ___
⑶H2O2是一種不穩定易分解的物質。右圖是H2O2在沒有催化劑時反應進程與能量變化圖,請在圖上畫出使用催化劑加快分解速率時能量與進程圖 。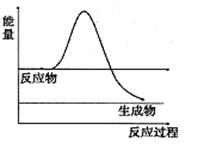
⑷某化學興趣小組欲測定H2O2的分解速率,取溶液0.5L進行分析,數據如表格所示:
| t(S) | 0 | 2 | 4 | 6 | 8 | 10 |
| n(H2O2) (moL) | 0.8 | 0.7 | 0.62 | 0.55 | 0.27 | 0.03 |

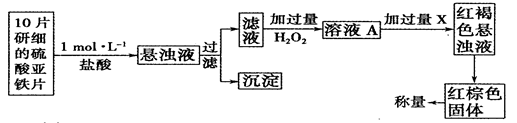
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
大氣中的部分碘源于O3對海水中I-的氧化。將O3持續通入NaI溶液中進行模擬研究.
(1)O3將I-氧化成I2的過程由3步反應組成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)  HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq) I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
總反應的化學方程式為__ ____,其反應△H=___ ___
(2)在溶液中存在化學平衡:I2(aq) + I-(aq)  I3-(aq),其平衡常數表達式為_______.
I3-(aq),其平衡常數表達式為_______.
(3)為探究Fe2+ 對O3氧化I-反應的影響(反應體如左圖),某研究小組測定兩組實驗中I3-濃度和體系pH,結果見右圖和下表。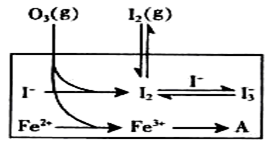
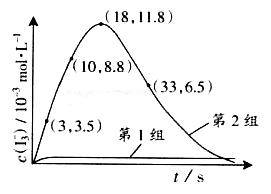
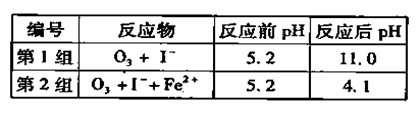
①第1組實驗中,導致反應后pH升高的原因是_______。
②圖13中的A為__ ___,由Fe3+生成A的過程能顯著提高Ⅰ-的轉化率,原因是 。
③第2組實驗進行18s后,I3-濃度下降。導致下降的直接原因有(雙選)______。
| A.c(H+)減小 | B.c(I-)減小 | C.I2(g)不斷生成 | D.c(Fe3+)增加 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
請參考題中圖表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根據要求回答問題: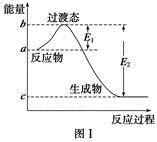
(1)圖Ⅰ是1 mol NO2(g)和1 mol CO(g)反應生成CO2和NO過程中的能量變化示意圖,若在反應體系中加入催化劑,反應速率增大,E1的變化是 (填“增大”、“減小”或“不變”,下同),ΔH的變化是 。請寫出NO2和CO反應的熱化學方程式: 。
(2)甲醇質子交換膜燃料電池中將甲醇蒸汽轉化為氫氣的兩種反應的熱化學方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,則甲醇蒸汽燃燒為液態水的熱化學方程式為 。
(3)如表所示是部分化學鍵的鍵能參數:
| 化學鍵 | P—P | P—O | O===O | P===O |
| 鍵能/kJ·mol-1 | a | b | c | x |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
碳及其化合物有廣泛的用途。
(1)將水蒸氣通過紅熱的碳即可產生水煤氣反應為
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反應達到平衡后,在體積不變的條件下,以下措施有利于提高H2O的平衡轉化率的是________。(填序號)
| A.升高溫度 | B.增加碳的用量 | C.加入催化劑 | D.用CO吸收劑除去CO |
 2CO(g) ΔH=+172.5 kJ·mol-1,則CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,則CO(g)+H2O(g) CO2(g)+H2(g)的焓變ΔH=________。
CO2(g)+H2(g)的焓變ΔH=________。 CH3OH(g)。甲醇是一種燃料,可利用甲醇設計一個燃料電池,用稀硫酸作電解質溶液,多孔石墨作電極,該電池負極反應式為______________________________________。
CH3OH(g)。甲醇是一種燃料,可利用甲醇設計一個燃料電池,用稀硫酸作電解質溶液,多孔石墨作電極,該電池負極反應式為______________________________________。 CO2(g)+H2(g)。得到如下數據:
CO2(g)+H2(g)。得到如下數據:| 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所 需時間/min | ||
| H2O | CO | H2 | CO | | |
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g) ΔH=-92.4 kJ·mol-1。實驗室模擬化工生產,分別在不同實驗條件下反應,N2濃度隨時間變化如圖甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。實驗室模擬化工生產,分別在不同實驗條件下反應,N2濃度隨時間變化如圖甲所示。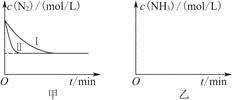
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在微生物作用的條件下,NH4+經過兩步反應被氧化成NO3-。這兩步的能量變化示意圖如下: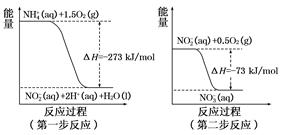
(1)第二步反應是 反應(選填“放熱”或“吸熱”),判斷依據是 。
(2)1 mol NH4+ (aq)全部氧化成NO2- (aq)的熱化學方程式是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
I.“低碳循環”引起各國的高度重視,而如何降低大氣中CO2的含量及有效地開發利用CO2,引起了全世界的普遍重視。所以“低碳經濟”正成為科學家研究的主要課題:
(1)將不同量的CO(g)和H2O(g)分別通入到體積為2L的恒容密閉容器中,進行反應:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二組數據:
CO2(g)+H2(g),得到如下二組數據:
| 實驗組 | 溫度℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知:①將煤轉化為水煤氣的主要化學反應為C(s)+H2O(g)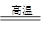 CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃燒的熱化學方程式分別為:
CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃燒的熱化學方程式分別為:
C(s)+O2(g)=CO2 (g);ΔH=-393.5 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g);ΔH=-283.0 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g);ΔH=-242.0 kJ·mol-1
請回答:
(1)根據以上信息,寫出CO與水蒸氣反應的熱化學方程式:____________________________。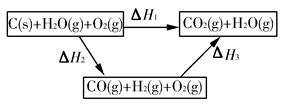
(2)如圖是根據蓋斯定律做出的循環圖,根據圖的轉化關系和熱化學方程式計算ΔH3=________kJ/mol。
請比較ΔH1與ΔH3數值是否可以說明用水煤氣做燃料要比直接燃煤放出的熱量多________(是或否)原因是___________________________________。
(3)目前煤的運輸還主要靠鐵路運輸和公路運輸,你能在所學知識基礎上提出緩解鐵路和公路運輸的方法:____________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com