
【題目】利用圖示裝置進行下列實驗,能達到實驗目的的是
溶液a | 固體b | 溶液c | 實驗目的:驗證 |
| |
A | 濃硝酸 | NaHCO3 | Na2SiO3 | 非金屬性:N>C>Si | |
B | 濃鹽酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 濃鹽酸 | CaCO3 | NaAlO2 | 酸性:HCl>H2CO3>Al(OH)3 | |
D | 濃氨水 | CaO | 酚酞溶液 | NH3·H2O是弱堿 |
A. A B. B C. C D. D
【答案】B
【解析】A、濃硝酸具有揮發性,生成的二氧化碳中混有硝酸氣體,硝酸也能與Na2SiO3反應生成硅酸沉淀,不能說明非金屬性:C>Si,故A錯誤;B、濃鹽酸與KMnO4反應生成氯氣,說明氧化性KMnO4>Cl2,氯氣與Na2S反應生成硫沉淀,說明氧化性:Cl2>S,因此氧化性:KMnO4>Cl2>S,故B正確;C、濃鹽酸具有揮發性,生成的二氧化碳中混有氯化氫氣體,氯化氫也能與NaAlO2反應生成氫氧化鋁沉淀,不能說明酸性:H2CO3>Al(OH)3,故C錯誤;D、濃氨水與CaO反應生成氨氣,氨氣的水溶液顯堿性,能夠是酚酞溶液變紅色,只能證明NH3·H2O是堿,不能證明其強弱,故D錯誤;故選A。


科目:高中化學 來源: 題型:
【題目】能源短缺是人類社會面臨的重大問題.甲醇是一種可再生能源,具有廣泛的開發和應用前景.
(1)工業上一般采用下列兩種反應合成甲醇: 反應I:CO(g)+2H2(g)CH3OH(g)△H1
反應II:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反應符合“原子經濟”原則的是(填“I”或“Ⅱ”).
②下表所列數據是反應I在不同溫度下的化學平衡常數(K).
溫度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中數據判斷△H10 (填“>”、“=”或“<”).
③某溫度下,將2mol CO和6mol H2充入2L的密閉容器中,充分反應,達到平衡后,測得c(CH3OH)=0.8mol/L,則CO的轉化率為 , 此時的溫度為(從上表中選擇).
④恒溫、恒容時,下列情況不能說明反應I已經達到化學平衡狀態的是 .
a、容器各物質的濃度保持不變; b、容器內壓強保持不變;
c、υ(CO)消耗═1/2υ(H2)生成 d、容器內的密度保持不變
(2)25℃、101kPa時,燃燒16g液體甲醇生成CO2和H2O(l),放出的熱量為363.26kJ,寫出甲醇燃燒的熱化學方程式: .
(3)某實驗小組依據甲醇燃燒的反應原理,設計一個燃料電池電解Na2SO4溶液(圖如下).請根據圖示回答下列問題: ①通入甲醇蒸氣的電極應為極(填寫“正”或“負”),該電極上發生的電極反應是(填字母代號).
a.2CH3OH﹣12e﹣+3O2═2CO2+4H2O
b.CH3 OH﹣6e﹣+8OH﹣═CO32﹣+6H2O
c.O2+2H2O+4e﹣═4OH﹣
d.O2﹣4e﹣+4H+═2H2O
②寫出電極A的名稱 . 寫出B電極的電極反應式 .
③當堿性甲醇燃料電池消耗3.36L 氧氣時(折合為標準狀況),理論上電解Na2SO4溶液生成氣體的總物質的量是 . 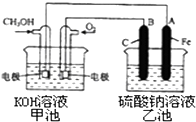
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A.用完的電池可以隨意丟棄
B.增加煉鐵高爐的高度可以降低尾氣中CO的含量
C.無論加入正催化劑還是加入負催化劑都能大大提高化學反應速率
D.把煤粉碎了再燃燒可以提高煤的燃燒效率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是重要的化工原料,又可作為燃料。工業上利用合成氣(主要成分為CO、CO2和H2) 在催化劑的作用下合成甲醇,發生的主反應如下:
①CO(g)+2H2(g) ![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-58kJ/mol
CH3OH(g)+H2O(g) △H=-58kJ/mol
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H=+41kJ/mol
CO(g)+H2O(g) △H=+41kJ/mol
回答下列問題:
(1)已知反應①中的相關的化學鍵鍵能數據如下:
化學鍵 | H-H | C-O | C=O | H-O | C-H |
E/(kJ/mol) | a | b | c | d | x |
則x=______。(用含表中字母的代數式表示)
(2)若將lmolCO2和2molH2充入容積為2L的恒容密閉容器中,在兩種不同溫度下發生反應②。測得CH3OH的物質的量隨時間的變化如圖所示。
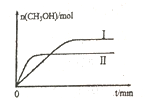
①曲線Ⅰ、Ⅱ對應的平衡常數大小關系為KⅠ_____KⅡ(填“>或“=”或“<”)
②一定溫度下,能判斷該反應達到化學平衡狀態的是______。
a.容器中壓強不變
b.甲醇和水蒸氣的體積比保持不變
c.v正(H2)=3v逆(CH3OH)
d.2個C=O斷裂的同時有3個H-H形成
③若5min后反應達到平衡狀態,H2的轉化率為90%,則用CO2表示的平均反應速率為_____,該溫度下的平衡常數為_____,若容器容積不變,下列措施可增加甲醇產率的是____。
a.升高溫度 b.使用合適的催化劑 c.充入He d.按原比例再充入CO2和H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅銅原電池裝置如圖所示,其中陽離子交換膜只允許陽離子和水分子通過,下列有關敘述正確的是( ) 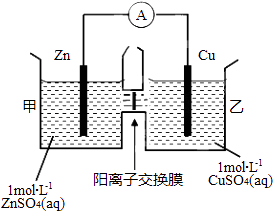
A.銅電極上發生氧化反應
B.電池工作一段時間后,甲池的c(SO42﹣)減小
C.電池工作一段時間后,乙池溶液的總質量增加
D.陰陽離子分別通過交換膜向負極和正極移動,保持溶液中電荷平衡
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲狀腺激素、血紅蛋白和葉綠素中含有的特征元素依次是( )
A. I、Mg、Fe B. Cu、Mg、I
C. I、Fe、Mg D. Fe、Mg、I
查看答案和解析>>
科目:高中化學 來源: 題型:
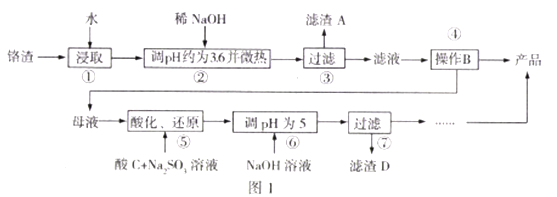
【題目】工業廢棄鉻渣對人體以及環境危害極大,鉻渣含有Na2SO4及少量Cr2O72-、Fe3+;某工廠從鉻渣中提取硫酸鈉的工藝如圖1:
己知:I.Fe3+、Cr3+完全沉淀(c≦1.0×10-5mol/L)時pH分別為3.6和5;
Ⅱ.Cr2O72-還原產物為Cr3+。
(1)步驟2調節pH=3.6的目的為______,“微熱”的作用為_______。
(2)Na2SO4和Na2Cr2O7的溶解度隨溫度變化曲線如圖2,操作B的方法為_________.
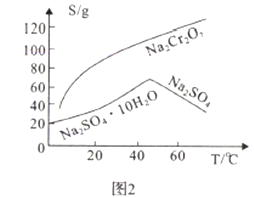
A.蒸發結晶、趁熱過濾 B.蒸發濃縮,降溫結晶,過濾
(3)步驟5中酸C不能選擇硝酸的理由為____________,酸化、還原過程發生反應的離子方程式為_______,若將該反應設計為原電池(惰性電極),則負極的電極反應式為_______。
(4)Cr(OH)3的溶度積常數Ksp[Cr(OH)3]=_______
(5)為了測定步驟3的濾液中Na2Cr2O7的濃度,進行步驟如下:
I.取100mL濾液;
Ⅱ.用cmol/L的標準KMnO4酸性溶液滴定bmL一定濃度的FeSO4溶液,消耗KMnO4溶液bmL;
Ⅲ.取bmL濾液,用上述FeSO4溶液滴定,達到滴定終點時,消耗dmLFeSO4溶液;則步驟3的濾液中Na2Cr2O7的含量為_________mol/L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com