
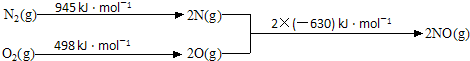

分析 (1)二氧化氮與氧氣、水恰好反應生成硝酸,根據方程式計算n(NO2):n(O2);
(2)①分析圖象變化,計算反應焓變=E1-E2,結合熱化學方程式書寫方法標注物質聚集狀態和對應反應的焓變;
②該反應為吸熱反應,根據溫度對平衡移動的影響分析;
(3)①NO被CO還原,則CO被NO氧化生成二氧化碳,據此寫出反應方程式;
②原子半徑越大,其吸收范圍越大,則吸收能力越強;
(4)①得電子的物質發生還原反應;
②NiO電極上NO失電子和氧離子反應生成二氧化氮.
解答 解:(1)二氧化氮與氧氣、水恰好反應生成硝酸,其反應的方程式為:4NO2+O2+2H2O=4HNO3,則n(NO2):n(O2)=4:1;
故答案為:4:1;
(2)①分析圖象變化,計算反應焓變△H=E1-E2=1443KJ/mol-1260KJ/mol=183KJ/mol,結合熱化學方程式書寫方法標注物質聚集狀態和對應反應的焓變,得到熱化學方程式為:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol;
故答案為:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol;
②該反應為吸熱反應,升高溫度平衡向正方向移動,則平衡常數增大;
故答案為:增大;
(3)①在催化劑條件下,一氧化碳被氧化生成二氧化碳,一氧化氮被還原生成氮氣,所以其反應方程式為:2CO+2NO $\frac{\underline{\;催化劑\;}}{\;}$N2+2CO2,
故答案為:2CO+2NO $\frac{\underline{\;催化劑\;}}{\;}$N2+2CO2;
②根據Mg、Ca、Sr和Ba的質子數,得知它們均為ⅡA族元素.同一主族的元素,從上到下,原子半徑逐漸增大,原子半徑越大,反應接觸面積越大,則吸收能力越大,
故答案為:根據Mg、Ca、Sr和Ba的質子數,得知它們均為ⅡA族元素,同一主族的元素,從上到下,原子半徑逐漸增大.
(4)①鉑電極上氧氣得電子生成氧離子而被還原,故答案為:還原;
②NiO電極上NO失電子和氧離子反應生成二氧化氮,所以電極反應式為:NO+O2--2e-=NO2,
故答案為:NO+O2--2e-=NO2.
點評 本題涉及化學反應方程式、熱化學反應方程式、電極反應式的書寫等知識點,注意反應熱的計算方法,為易錯點,題目難度中等,側重于考查學生的分析能力和對基礎知識的綜合應用能力.


科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=1的溶液中:K+、Cr2O72-、C6H5OH、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Cu2+、Na+、Cl-、SO42- | |
| C. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、Cl-、NO3- | |
| D. | 0.1 mol/L Na2SiO3溶液中:K+、Cl-、NO3-、CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 25℃時,pH=1的醋酸溶液中含有H+的數目為0.1NA | |
| B. | 100mL 18.4mol•L-1 的濃硫酸與足量的銅加熱反應后,生成SO2 分子數為0.92NA | |
| C. | 將CO2 通過Na2O2 ,當固體質量增加a g時,反應中轉移的電子數為a$\frac{{N}_{A}}{28}$ | |
| D. | 標準狀況下,11.2L正丁烷所含公用電子對數為7NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溶解度(S)/g | 溶度積(Ksp) | 摩爾質量(M)/g•mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | x=y | B. | x>y | C. | x<y | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 軟脂酸 C17H35COOH | B. | 新戊烷 C(CH3)4 | ||
| C. | 甘氨酸 H2NCH2COOH | D. | 甘油 CH2(OH)CH(OH)CH2OH |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com