
常溫下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列順序為 (填序號);
(2)實驗室配制⑤的溶液時常需加入少量鹽酸,否則得到的是渾濁的溶液,產生渾濁的原因是(用離子方程式表示)
(3)物質的量濃度相同的①氨水②氯化銨③碳酸氫銨④硫酸氫銨⑤硫酸銨
在上述五種溶液中,銨根離子物質的量濃度由大到小的順序是
(4)已知拆開1molH—H鍵,1molN—H鍵,1molN≡N鍵分別需要的能量是436kJ、39l kJ、946 kJ,則N2與H2反應生成NH3的熱化學方程式為
(1)①②⑤⑥③④ (2)Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
(3)⑤>④>②>③>① (4)N2(g)+3H2(g) 2NH3(g)
2NH3(g) 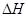 =-92.0kJ/mol
=-92.0kJ/mol
解析試題分析:(1)鹽酸是一元強酸,醋酸是一元弱酸,醋酸鈉是弱酸強堿鹽,氫氧化鈉是一元強堿。氯化鐵是強酸弱堿鹽,氯化鈉是強酸強堿鹽,所以在濃度相等的條件下,pH由小到大排列順序為①②⑤⑥③④。
(2)氯化鐵溶于水,鐵離子水解生成氫氧化鐵和鹽酸,所以加入鹽酸的目的是抑制鐵離子的水解,方程式是Fe3++3H2O Fe(OH)3+3H+。
Fe(OH)3+3H+。
(3)在溶液中NH4+水解,而硫酸氫銨能電離出氫離子,抑制NH4+水解。HCO3-水解,顯堿性,促進NH4+水解,所以五種溶液中,銨根離子物質的量濃度由大到小的順序是⑤>④>②>③>①。
(4)反應熱是斷鍵吸收的能量和形成化學鍵所放出的能量的差值,則該反應的反應熱△H=3×436kJ/mol+946kJ/mol-2×3×391kJ/mol=-92.0kJ/mol,所以反應的熱化學方程式是N2(g)+3H2(g) 2NH3(g)
2NH3(g) 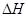 =-92.0kJ/mol。
=-92.0kJ/mol。
考點:考查pH的判斷、鹽類水解的應用、溶液中離子濃度比較以及反應熱的計算
點評:該題是高考中的常見題型,屬于中等難度的試題。試題綜合性強,差值對學生靈活運用基礎知識解決實際問題的能量的培養。旨在提高學生分析、歸納、總結問題的能力。有利于調動學生的學習興趣和學習積極性,也有助于培養學生的邏輯推理能力和抽象思維能力。


科目:高中化學 來源:2011-2012學年福建省上杭一中高二下學期期末考試化學試卷(帶解析) 題型:填空題
(8分,每空格2分)常溫下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列順序為 (填序號);
(2)實驗室配制⑤的溶液時常需加入少量鹽酸,否則得到的是渾濁的溶液,產生渾濁的原因是(用離子方程式表示)
(3)物質的量濃度相同的①氨水②氯化銨③碳酸氫銨④硫酸氫銨⑤硫酸銨
在上述五種溶液中,銨根離子物質的量濃度由大到小的順序是
(4)已知拆開1molH—H鍵,1molN—H鍵,1molN≡N鍵分別需要的能量是436kJ、39lkJ、946kJ,則N2與H2反應生成NH3的熱化學方程式為
查看答案和解析>>
科目:高中化學 來源:2014屆河南靈寶第三高級中學高二下學期第三次檢測化學卷(解析版) 題型:填空題
常溫下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列順序為 (填序號);
(2)實驗室配制⑤的溶液時常需加入少量鹽酸,否則得到的是渾濁的溶液,產生渾濁的原因是(用離子方程式表示)
(3)物質的量濃度相同的①氨水②氯化銨③碳酸氫銨④硫酸氫銨⑤硫酸銨
在上述五種溶液中,銨根離子物質的量濃度由大到小的順序是
(4)已知拆開1molH—H鍵,1molN—H鍵,1molN≡N鍵分別需要的能量是436kJ、39l kJ、946 kJ,則N2與H2反應生成NH3的熱化學方程式為
查看答案和解析>>
科目:高中化學 來源:2014屆江西省高二第二次月考化學試卷(解析版) 題型:填空題
(15分)(Ⅰ)在溫度t ℃時,pH=3的某水溶液中c(OH-)=10-9 mol/L在此溫度下pH均為4的鹽酸和(NH4)2SO4溶液中由水電離出的c(H+)之比為__________。
(Ⅱ)常溫下,pH=10的強堿AOH和pH=4的酸HnB等體積混合后溶液顯酸性,生成的鹽化學式為___________。AOH與HnB完全中和所得溶液呈_________性,其原因用離子方程式表_______________________________________。
(Ⅲ)常溫下將體積為v1、濃度為c1的一元酸HA與體積為v2、濃度為c2的一元堿BOH混合。
(1)若v1·c1=v2·c2,混合后的溶液pH>7,則一元弱酸的電離程度 (選填“>”、“<”或“=”)一元弱堿的電離程度;
(2)若v1=v2,一元弱堿的電離程度大于一元弱酸的電離程度,且混合后溶液pH<7,則c1 c2(選填“>”、“<”或“=”)。
(Ⅳ)常溫下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列順序為 (填序號);
(2)實驗室配制⑤的溶液時常需加入少量鹽酸,否則得到的是渾濁的溶液,產生渾濁的原因是(用離子方程式表示)
(Ⅴ)將硫酸鋁溶液和碳酸氫鈉溶液混合時,可看到的實驗現象是 ,產生該現象的原因是 (用離子方程式解釋原因)。
查看答案和解析>>
科目:高中化學 來源:2013屆福建省高二下學期期末考試化學試卷(解析版) 題型:填空題
(8分,每空格2分)常溫下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列順序為 (填序號);
(2)實驗室配制⑤的溶液時常需加入少量鹽酸,否則得到的是渾濁的溶液,產生渾濁的原因是(用離子方程式表示)
(3)物質的量濃度相同的①氨水②氯化銨③碳酸氫銨④硫酸氫銨⑤硫酸銨
在上述五種溶液中,銨根離子物質的量濃度由大到小的順序是
(4)已知拆開1molH—H鍵,1molN—H鍵,1molN≡N鍵分別需要的能量是436kJ、39lkJ、946kJ,則N2與H2反應生成NH3的熱化學方程式為
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com