
Ⅰ在催化劑作用下,CO2和H2可以制取甲醇。用工業廢氣中的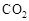 可制取甲醇,其反應為:CO2+3H2
可制取甲醇,其反應為:CO2+3H2 CH3OH+H2O 常溫常壓下已知下列反應的能量變化如圖示:
CH3OH+H2O 常溫常壓下已知下列反應的能量變化如圖示:
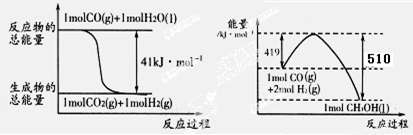
寫出由二氧化碳和氫氣制備甲醇的熱化學方程式: 。
Ⅱ硼氫化鈉(NaBH4)是有機合成中的重要還原劑。最新研究發現,以NaBH4和H2O2為原料,NaOH溶液作電解質溶液,可以設計成全液流電池,其工作原理如圖所示,假設電池工作前左右兩槽溶液的體積各為1L,回答下列問題:
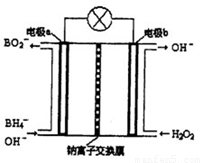
(1)電極b為 (填“正極”或“負極”),電極a上發生反應的電極反應式為 。
(2)電池工作時,Na+向 極(填“a”或“b”)移動,當左槽產生0.0125molBO2—離子時,右槽溶液pH=
(3)用該電池電解一定濃度的CuSO4溶液至無色后繼續電解一段時間。斷開電路,向溶液中加入0.1molCu(OH)2,溶液恢復到電解之前狀態,則電解過程中轉移電子數目為_________
ⅠCO2(g)+3H2(g)=CH3OH(l)+H20(l) △H=-50kJ/mol
Ⅱ.(1)正 BH4-+8OH- -8e- =BO2- +6H2O (2)b 13 (3)0.4NA
【解析】
試題分析:Ⅰ如圖所示可以得出兩個熱化學方程式:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol;2H2(g)+CO(g)=CH3OH(l) △H=-510kJ/mol;根據蓋期定律,用后面的方程式減去前者方程式可得:CO2(g)+3H2(g)=CH3OH(l)+H20(l) △H=-50kJ/mol。(1)正極電極反應式為H2O2+2e-=2OH-,故電極b為正極,負極發生氧化反應生成BO2-,電極a反應式為BH4-+8OH--8e-=BO2-+6H2O。(2)原電池工作時,陽離子向正極移動,陰離子向負極移動,則Na+從a極區移向b極區。當左槽產生0.0125molBO2—離子時,根據電子守恒,右槽生成氫氧根離子0.1mol,右槽溶液pH=13。(3)根據電子守恒原理,用該電池電解一定濃度的CuSO4溶液至無色后繼續電解一段時間。電解方程式為:2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4 ,向溶液中加入0.1molCu(OH)2,溶液恢復到電解之前狀態,說明有0.1mol硫酸生成,則電解過程中轉移電子數目為0.2mol。
考點:本題考查原電池工作原理,涉及電極判斷與電極反應式書寫等問題,做題時注意從氧化還原的角度判斷原電池的正負極以及電極方程式的書寫,本題中難點和易錯點為電極方程式的書寫,注意化合價的變化。


 寒假樂園北京教育出版社系列答案
寒假樂園北京教育出版社系列答案科目:高中化學 來源: 題型:




 則反應①、②、③的反應類型分別為
則反應①、②、③的反應類型分別為



查看答案和解析>>
科目:高中化學 來源: 題型:
| 催化劑 |
| △ |
查看答案和解析>>
科目:高中化學 來源: 題型:
 +Br2
+Br2| Fe |
 +HBr
+HBr +Br2
+Br2| Fe |
 +HBr
+HBr

 +3Br2→
+3Br2→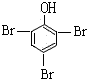 ↓+3HBr
↓+3HBr +3Br2→
+3Br2→ ↓+3HBr
↓+3HBr

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2011-2012學年北京市懷柔區高二(上)期末化學試卷(解析版) 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com