
【題目】根據所學知識,回答下列問題:
(1)現有下列物質;①熔融的NaCl ②液態HCl ③蔗糖 ④汞 ⑤NaOH溶液 ⑥稀硫酸 ⑦CO2 ⑧KCl晶體
其中屬于電解質的是__________;屬于非電解質的是__________;能導電的有__________。
(2)按要求填空。
①NaHSO4溶液(寫出電離方程式)____________________________。
②蘇打和澄清石灰水反應(寫出離子方程式)_______________________________
(3)配平下列氧化還原方程式:
①_____Fe+_____HNO3 = _____Fe(NO3)3+_____NO↑+_____H2O
②____CO+____ Fe2O3 ![]() ____Fe+_____CO2
____Fe+_____CO2
【答案】①②⑧ ③⑦ ①④⑤⑥ NaHSO4 = Na++H++ SO42- CO32-+Ca2+=CaCO3↓ 1 4 1 1 2 3 1 2 3
【解析】
(1)在水溶液里或熔融狀態下能導電的化合物是電解質,在水溶液里和熔融狀態下都不導電的化合物是非電解;能導電的物質中含有自由移動的電子或離子,據此解答;
(2)①硫酸氫鈉為強電解質,水溶液中完全電離產生鈉離子、氫離子和硫酸根離子;②碳酸鈉與氫氧化鈣反應生成碳酸鈣沉淀和氫氧化鈉;
(3)首先分析元素化合價變化,再依據氧化還原反應得失電子守恒配平方程式。
(1)①熔融的NaCl中含有自由移動的離子,能夠導電;在水溶液里或熔融狀態下能導電,屬于電解質;②液態HCl中不含自由移動的離子和電子,不導電;在水溶液里能導電,屬于電解質;③蔗糖中不含自由移動的離子和電子,不導電;在水溶液里和熔融狀態下都不導電,是非電解質;④汞是單質,含有自由移動的電子,能夠導電,既不是電解質,也不是非電解質;⑤Na2OH溶液中含自由移動的離子能夠導電;是混合物,既不是電解質,也不是非電解質;⑥稀硫酸溶液中含自由移動的離子能夠導電;是混合物,既不是電解質,也不是非電解質;⑦CO2中不含自由移動的離子和電子,不導電;本身不能電離產生自由移動的離子,是非電解質;⑧KCl晶體中不含自由移動的離子和電子,不導電;在水溶液里或熔融狀態下能導電,屬于電解質;屬于電解質的是①②⑧;屬于非電解質的是③⑦;能導電的有①④⑤⑥;故答案為:①②⑧;③⑦;①④⑤⑥;
(2)①硫酸氫鈉為強電解質,水溶液中完全電離產生鈉離子、氫離子和硫酸根離子,電離方程式:NaHSO4=Na++H++SO42-,故答案為:NaHSO4=Na++H++SO42-;
②蘇打和澄清石灰水反應的化學方程式為:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,Na2CO3、Ca(OH)2、NaOH都改寫成離子,CaCO3難溶于水以化學式保留,離子方程式為:Ca2++CO32-=CaCO3↓,故答案為:Ca2++CO32-=CaCO3↓;
(3)①Fe元素的化合價由0價升至Fe(NO3)3中的+3價,升高3價,N元素的化合價由HNO3中的+5價降至NO中的+2價,降低3價,根據元素化合價升降總數相等配平:1Fe+1HNO3→1Fe(NO3)3+1NO↑+H2O;觀察Fe(NO3)3中N元素的化合價與HNO3中N元素的化合價一致,根據原子守恒調整HNO3的化學計量數,進而確定H2O的化學計量數,配平為:1Fe+4HNO3=1Fe(NO3)3+1NO↑+2H2O,故答案為:1;4;1;1;2;
②反應中碳元素化合價從+2價升高為+4價,鐵元素從+3價降為0價,依據氧化還原反應得失電子守恒、原子個數守恒方程式:3CO+Fe2O3═2Fe+3CO2,故答案為:3;1;2;3。


科目:高中化學 來源: 題型:
【題目】下圖表示滲透作用裝置圖,其中半透膜為膀胱膜,甲、丙裝置中A、B、a、b溶液濃度分別用MA、MB、Ma、Mb表示,乙、丁裝置分別表示一段時間后甲、丙裝置的狀態,液面上升的高度分別為h1、h2。如果A、B、a、b均為蔗糖溶液,且MA>MB,Ma=Mb>MA,則達到平衡后( )


A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為2L的恒容密閉容器中發生反應xA(g)+ yB(g)![]() zC(g),圖I表示200℃時容器中A、B、C物質的量隨時間的變化,圖Ⅱ表示不同溫度下平衡時C的體積分數隨起始n(A):n(B)的變化關系;則下列結論正確的是
zC(g),圖I表示200℃時容器中A、B、C物質的量隨時間的變化,圖Ⅱ表示不同溫度下平衡時C的體積分數隨起始n(A):n(B)的變化關系;則下列結論正確的是
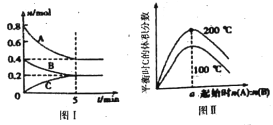
A. 圖II所知反應xA(g)+yB(g) ![]() zC(g) △H<0,且a=2
zC(g) △H<0,且a=2
B. 200℃時,該反應的平衡常數為25
C. 200℃時,反應從開始到平衡的平均速率v(B)=0.04mol/(Lmin)
D. 當外界條件由200℃降溫到100℃,原平衡一定被破壞,且正逆反應速率均增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】制備硅單質時,主要化學反應如下:
(1)SiO2+2C![]() Si+2CO↑
Si+2CO↑
(2)Si+2Cl2![]() SiCl4
SiCl4
(3)SiCl4+2H2![]() Si+4HCl
Si+4HCl
下列對上述三個反應的敘述中,不正確的是( )
A. (1)(3)為置換反應 B. (1)(2)(3)均為氧化還原反應
C. (2)為化合反應 D. 三個反應的反應物中硅元素均被還原
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有A、B、C、D、E、F、G、H、M九種物質,其中A為淡黃色粉末,B為日常生活中最常見無色無味液體, E為無色氣體單質,F的水溶液與石灰水混合可得D的溶液,G為黃綠色氣體單質,H是漂白液的有效成分,它們之間的相互轉化關系如圖所示,其他與題無關的生成物均已略去。
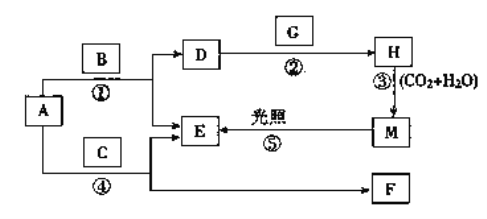
請回答下列問題:
(1)寫出G、H的化學式:G________,H________。D的俗名是__________。
(2)寫出反應②的離子方程式:_________________________________________。
(3)利用下圖裝置進行實驗,證明氧化性強弱:KMnO4>Cl2>Br2。
限選試劑:KBr溶液、KMnO4、濃鹽酸。
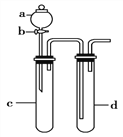
已知:2KMnO4+16HCl(濃)=2KCl+ 2MnCl2+5Cl2↑+8H2O
請回答下列問題:
裝置a 的名稱是____________________,d中盛放的試劑是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組研究NaClO溶液與KI溶液的反應,實驗記錄如下:
實驗編號 | 實驗操作 | 實驗現象 |
Ⅰ |
| ⅰ.溶液變為淺黃色 ⅱ.溶液變藍 |
Ⅱ |
| ⅰ.溶液保持無色 ⅱ.溶液不變藍,溶液的pH=10 |
【資料】:碘的化合物主要以I和IO3的形式存在。酸性條件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加熱的條件下極不穩定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用離子方程式表示其原因:______。
(2)實驗Ⅰ中溶液變為淺黃色的離子方程式是______。
(3)對比實驗Ⅰ和Ⅱ,研究實驗Ⅱ反應后“溶液不變藍”的原因。
① 提出假設a:I2在堿性溶液中不能存在。設計實驗Ⅲ證實了假設a成立,實驗Ⅲ的操作及現象是______。
② 進一步提出假設b:NaClO可將I2氧化為IO3。進行實驗證實了假設b成立,裝置如下圖,其中甲溶液是______,實驗現象是______。

(4)檢驗實驗Ⅱ所得溶液中的IO3:
取實驗Ⅱ所得溶液,滴加稀硫酸至過量,整個過程均未出現藍色,一段時間后有黃綠色刺激性氣味的氣體產生,測得溶液的pH=2。再加入KI溶液,溶液變藍,說明實驗Ⅱ所得溶液中存在IO3。
① 產生的黃綠色氣體是______。
② 有同學認為此實驗不能說明實驗Ⅱ所得溶液中存在IO3,理由是______。欲證明實驗Ⅱ所得溶液中存在IO3,改進的實驗方案是______。
③ 實驗Ⅱ中反應的離子方程式是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用菱錳礦(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等雜質]為原料制取二氧化錳,其流程示意圖如下:
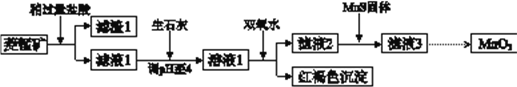
已知:生成氫氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
開始沉淀時 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀時 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金屬離子的起始濃度為0.1 mol/L
回答下列問題:
(1)含雜質的菱錳礦使用前需將其粉碎,主要目的是_________。鹽酸溶解MnCO3的化學方程式是_________。
(2)向溶液1中加入雙氧水時,反應的離子方程式是___________。
(3)濾液2中加入稍過量的難溶電解質MnS,以除去Cu2+,反應的離子方程式是__________。
(4)將MnCl2轉化為MnO2的一種方法是氧化法。用酸化的NaClO3溶液將MnCl2氧化生成MnO2和Cl2,該反應的離子方程式為___________。
(5)將MnCl2轉化為MnO2的另一種方法是電解法。
① 生成MnO2的電極反應式是___________。
② 若直接電解MnCl2溶液,生成MnO2的同時會產生少量Cl2。檢驗Cl2的操作是_________。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,則無Cl2產生。其原因是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】弱電解質的電離平衡、鹽類的水解平衡和難溶物的溶解平衡均屬于化學平衡。
I.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
(1)Na2A溶液顯____(填“酸性、中性、或堿性”),理由是(用離子方程式表示):_______。
(2)已知0.1mol/L的NaHA溶液的pH=2,則0.1mol/L的H2A溶液中(H+)_____(填“<”“>”或“=”)0.11mol/L,理由是____________。
(3)若向0.1mol/L的H2A溶液中加入等體積等濃度的NaOH溶液,則溶液中各離子濃度由大到小的順序為______________。
(4)某溫度下,純水中的c(H+)=4.0×10-7mol/L,若溫度不變,滴入稀NaOH溶液,使c(OH-)=5.0×10-6moL/L,則溶液的c(H+)=______mol/L;pH相等的NaOH溶液與CH3COONa溶液,分別加熱到相同的溫度后CH3COONa 溶波的pH_____NaOH溶液的pH(填“>”“=”或“<”);
II.含有Cr2O72-的廢水毒性較大,某工廠廢水中含5.0×10-3mol/L的Cr2O72-。為了使廢水的排放達標,進行如下處理:
![]()
(5)若處理后的廢水中殘留的c(Fe3+)=4.0×10-13mol/L,則殘留的Cr3+的濃度為____mo/L(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-33)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】粗鹽中常含有少量的泥沙及氯化鈣、氯化鎂、硫酸鹽等一些可溶性的雜質。粗鹽的提純實驗操作步驟如下圖所示:
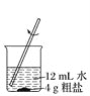

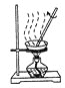
① ② ③
(1)請寫出圖中各步實驗操作的名稱①________,②________,③________。
(2)實驗操作②的主要目的是____________________。
(3)實驗操作③的目的是________________________。
(4)實驗操作①②③中都使用的儀器是________,它在③中其作用是____________________。
(5)通過上述實驗操作,得到的精鹽中可能含有的雜質是__________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com