
| A. | 1 mol甲醇分子中含有的共價鍵數為4 NA | |
| B. | 7.8g Na2O2固體與水完全反應時,轉移的電子數為0.1NA | |
| C. | 標準狀況下,11.2 L水中含有的氧原子數為0.5 NA | |
| D. | 1 L 0.5 mol/L CH3COONa溶液中含有的CH3COO-數為0.5 NA |
分析 A.1mol甲醇分子中含有3mol碳氫鍵、1mol碳氧鍵和1mol氧氫鍵,總共含有5mol共價鍵;
B.根據n=$\frac{m}{M}$計算出過氧化鈉的質量,然后可得出生成氧氣的物質的量,再結合過氧化鈉中氧元素的化合價為-1價計算轉移電子數;
C.標準狀況下水的狀態不是氣態;
D.醋酸為弱酸,在溶液中不能部分電離出醋酸根離子.
解答 解:A.甲醇分子中含有3個碳氫鍵、1個碳氧鍵和1個氧氫鍵,所以1mol甲醇中含有5mol共價鍵,含有的共價鍵數目為5NA,故A錯誤;
B.7.8g過氧化鈉的物質的量為:$\frac{7.8g}{78g/mol}$=0.1mol,0.1mol過氧化鈉與水完全反應生成0.05mol氧氣,轉移電子的物質的量為:0.05mol×2=0.1mol,轉移的電子數為0.1NA,故B正確;
C.標準狀況下水不是氣體,不能使用標準狀況下的氣體摩爾體積計算,故C錯誤;
D.1 L 0.5 mol/L CH3COONa溶液中含有0.5mol醋酸,由于醋酸部分電離出醋酸根離子,則溶液中含有的CH3COO-數小于0.5 NA,故D錯誤;
故選B.
點評 本題考查阿伏加德羅常數的綜合應用,題目難度中等,注意掌握好以物質的量為中心的各化學量與阿伏加德羅常數的關系,C為易錯點,注意明確標準狀況下氣體摩爾體積的使用條件.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
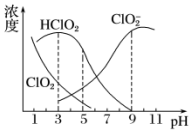 亞氯酸鈉是一種高效氧化劑、漂白劑,主要用于棉紡、亞麻、紙漿等漂白.亞氯酸鈉(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.經測定,25℃時各組分含量隨pH變化情況如圖所示(Cl-沒有畫出).則下列分析不正確的是( )
亞氯酸鈉是一種高效氧化劑、漂白劑,主要用于棉紡、亞麻、紙漿等漂白.亞氯酸鈉(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.經測定,25℃時各組分含量隨pH變化情況如圖所示(Cl-沒有畫出).則下列分析不正確的是( )| A. | 亞氯酸鈉在堿性條件下較穩定 | |
| B. | 25℃時,HClO2的電離平衡常數的數值Ka約為10-6 | |
| C. | 使用該漂白劑的最佳pH為3 | |
| D. | ClO2可用于自來水的消毒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學式為Na2CO3 | B. | 受熱不分解 | C. | 屬于鹽 | D. | 與鹽酸不反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 事實 | 推測 |
| A. | Na與冷水反應劇烈,K與冷水反應更劇烈 | Li與冷水反應緩慢 |
| B. | 20Ca(OH)2堿性強于12Mg(OH)2 | 38Sr(OH)2堿性強于20Ca(OH)2 |
| C. | Si是半導體材料,同主族的Ge也是半導體材料 | 第ⅣA元素形成的單質都是半導體材料 |
| D. | F2與H2在暗處劇烈化合,Cl2與H2光照或點燃時反應 | Br2與H2反應需要加熱到一定溫度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石英是制造光導纖維的原料,也是常用的半導體材料 | |
| B. | 氧化鋁是冶煉金屬鋁的原料,也是較好的耐火材料 | |
| C. | 與銅質水龍頭的鋼質水管,在連接處易發生腐蝕 | |
| D. | 大量燃燒化石燃料是造成霧霾的重要因素之一 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗 | a中物質 | b中現象 | 結論或解釋 | |
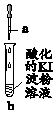 | A. | Fe(OH)3懸濁液 | Fe(OH)3懸濁液溶解,溶液變藍 | 發生反應:2Fe(OH)3+6H++2I-=2Fe2++6H2O+I2 |
| B. | NaClO3溶液 | 先變藍后褪色 | 褪色的反應:2ClO3-+10I-+12H+═Cl2+5I2+6H2O | |
| C. | \ | 空氣中放置一段時間,溶液變藍 | 發生反應:4I-+4H++O2=2I2+2H2O | |
| D. | 含碘元素的無色溶液 | 溶液呈藍色 | 可能發生的反應:5I-+IO3-+6H+=3I2+3H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑤ | B. | 只有⑤ | C. | 只有① | D. | ②③ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com