
【題目】黃銅礦(CuFeS2)是煉銅的最主要礦物,在野外很容易被誤會為黃金,又稱愚人金.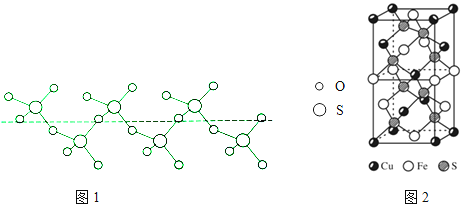
(1)火法冶煉黃銅礦的過程中,利用了Cu2O與Cu2S反應生成Cu單質,反應的化學方程式是
(2)S位于周期表中 族,該族元素氫化物中,H2Te比H2S沸點高的原因是 ,H2O比H2Te沸點高的原因是
(3)S有+4和+6兩種價態的氧化物,回答下列問題:
①下列關于氣態SO3和SO2的說法中,正確的是 .
A.中心原子的價層電子對數目相等 B.都是極性分子
C.中心原子的孤對電子數目相等 D.都含有極性鍵
②將純液態SO3冷卻到289.8K時凝固得到一種螺旋狀單鏈結構的固體,其結構如圖1,此固態SO3中S原子的雜化軌道類型是
(4)Cu有+1和+2兩種價態的化合物,回答下列問題:
①Cu+的價層電子排布為 ,Cu2+有 個未成對電子.
②新制的Cu(OH)2能夠溶解于過量濃堿溶液中,反應的離子方程式是
(5)CuFeS2的晶胞如圖2所示,晶胞參數a=0.524nm,c=1.032nm;CuFeS2的晶胞中每個Cu原子與 個S原子相連,列式計算晶體密度 ρ= gcm﹣3 .
【答案】
(1)2Cu2O+Cu2S![]() 6Cu+SO2↑
6Cu+SO2↑
(2)ⅥA;兩者均為分子晶體且結構相似,H2Te相對分子質量比H2S大,分子間作用力更強;兩者均為分子晶體,H2O分子中存在氫鍵
(3)AD;sp3
(4)3d10;1;Cu(OH)2+2OH﹣=[Cu(OH)4]2﹣;4;![]() ?
?
【解析】(1)Cu2O與Cu2S反應生成Cu單質,還生成二氧化硫,反應為2Cu2O+Cu2S![]() 6Cu+SO2↑,所以答案是:2Cu2O+Cu2S
6Cu+SO2↑,所以答案是:2Cu2O+Cu2S![]() 6Cu+SO2↑;
6Cu+SO2↑;
(2)S的原子結構有3個電子層,最外層電子數為6,位于第ⅥA族,H2Te、H2S中相對分子質量大的沸點高,則H2Te沸點高,H2O比H2Te沸點高的原因是兩者均為分子晶體,H2O分子中存在氫鍵,
所以答案是:ⅥA;兩者均為分子晶體且結構相似,H2Te相對分子質量比H2S大,分子間作用力更強;兩者均為分子晶體,H2O分子中存在氫鍵;
(3)①SO3中價電子對為3,沒有孤對電子,為平面三角形;而SO2中價電子數為3,孤對電子數為1,為V型,則
A.中心原子的價層電子對數目相等,故A正確;
B.三氧化硫是非極性分子,故B錯誤;
C.中心原子的孤對電子數目不等,故C錯誤;
D.都含有S與O之間的極性鍵,故D正確;
所以答案是:AD;
②圖1中固態SO3中S原子形成4個共價單鍵,的雜化軌道類型是sp3 , 所以答案是:sp3;
(4)①Cu的原子序數為29,價電子為3d104s1 , Cu+的價層電子排布為3d10 , Cu2+中3d軌道上有9個電子,只有1個單電子,所以答案是:3d10;1;
②新制的Cu(OH)2能夠溶解于過量濃堿溶液,生成絡離子,反應的離子方程式是為Cu(OH)2+2OH﹣=[Cu(OH)4]2﹣ , 所以答案是:Cu(OH)2+2OH﹣=[Cu(OH)4]2﹣;
(5)由面心上Cu與2個S相連,晶胞中每個Cu原子與4個S相連;8個S均在體內,由化學式為CuFeS2 , 則含晶胞質量為![]() , 晶胞參數a=0.524nm,c=1.032nm,體積為(0.524×10﹣7cm)2×1.032×10﹣7cm,ρ=
, 晶胞參數a=0.524nm,c=1.032nm,體積為(0.524×10﹣7cm)2×1.032×10﹣7cm,ρ=![]() =
=![]() gcm﹣3 ,
gcm﹣3 ,
所以答案是:4;![]() .
.


科目:高中化學 來源: 題型:
【題目】Fe2+、Fe3+與O22﹣、CN﹣、F﹣、有機分子等形成的化合物具有廣泛的應用. 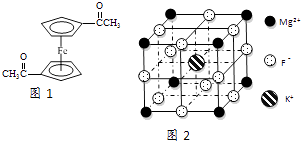
(1)C、N、O原子的第一電離能由大到小的順序是
(2)Fe2+基態核外電子排布式為 .
(3)乙酰基二茂鐵是常用汽油抗震劑,其結構如圖1所示.此物質中碳原子的雜化方式是 .
(4)配合物K3Fe(CN)6可用于電子傳感器的制作.與配體互為等電子體的一種分子的化學式為 . 已知(CN)2是直線型分子,并具有對稱性,則(CN)2中π鍵和σ鍵的個數比為 .
(5)F﹣不僅可與Fe3+形成[FeF6]3﹣ , 還可以與Mg2+、K+形成一種立方晶系的離子晶體,此晶體應用于激光領域,結構如圖2所示.該晶體的化學式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于摩爾質量的描述或應用中,正確的是( )
A.1mol OH-的質量為17g/mol
B.二氧化碳的摩爾質量為44g
C.鐵原子的摩爾質量等于它的相對原子質量
D.一個鈉原子的質量等于23/(6.02×1023)g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】液體燃料電池相比于氣體燃料電池具有體積小等優點。一種以液態肼(N2H4)為燃料的電池裝置如圖所示,該電池用空氣中的氧氣作為氧化劑,KOH溶液作為電解質溶液。下列關于該電池的敘述正確的是
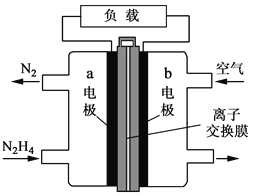
A. b極發生氧化反應
B. a極的反應式:N2H4+4OH--4e-=N2↑+4H2O
C. 放電時,電流從a極經過負載流向b極
D. 其中的離子交換膜需選用陽離子交換膜
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列選項與膠體知識無關的是( )
A. 膠體中分散質粒子的直徑大于溶液中分散質的粒子直徑
B. 向飽和的氯化鐵溶液中加入氫氧化鈉溶液得到紅褐色沉淀
C. 黃河入海口處形成三角洲
D. 氫氧化鐵溶膠、稀豆漿、云霧等均具有丁達爾現象
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學興趣小組為探究鐵與濃硫酸反應,設計了圖1、圖2所示裝置進行實驗。 
(1)比較兩實驗裝置,圖2所示裝置的優點是: ①能更好地吸收有毒氣體SO2 , 防止其污染環境;
②。
(2)能說明有SO2氣體產生的實驗現象是?
(3)反應一段時間后,用滴管吸取A試管中的溶液滴入適量水中為試樣,試樣中所含金屬離子的成分有以下三種可能: Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
為驗證Ⅱ、Ⅲ的可能性,選用如下試劑,填寫下列空白:
A.稀鹽酸溶液 B.稀硫酸溶液
C.KSCN溶液 D.KMnO4溶液
E.NaOH溶液 F.淀粉KI溶液
G.H2O2溶液
驗證Ⅱ:取試樣,先滴加少量的(填試劑序號,下同),振蕩,再滴加少量的 , 根據溶液顏色的變化可確定假設Ⅱ是否正確。
驗證Ⅲ:步驟1.取試樣,滴加少量的(填試劑序號),溶液的顏色變色則試樣中含有Fe3+ , 發生反應的離子方程式為。
步驟2.再取適量的試樣滴加到少量的(填試劑序號),溶液的顏色變為色,則試樣中含有Fe2+。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com