
分析 (1)氯氣的物理性質分析,氯氣是一種黃綠色有刺激性氣味的有毒氣體,氫氣在氯氣中燃燒放出蒼白色火焰,生成氯化氫氣體;
(2)濃硫酸具有酸性生成鹽,具有強氧化性硫元素化合價+6價變化為+4價,具有吸水性可以吸收氣體中的水蒸氣,具有脫水性可以使含碳、氫、氧元素的物質中氫元素原子和氧元素原子以2:1脫去,銅和濃硫酸加熱反應生成硫酸銅、二氧化硫和水;
(3)工業合成氨的原料為氫氣和氮氣;實驗室用氯化銨和熟石灰的固體混合物加熱來制取氨氣;
(4)自然界形成一氧化氮是利用空氣中的氮氣和氧氣放電反應生成,若每2mol NO2和Na2CO3溶液反應時轉移電子1mol計算生成的硝酸,根據化合價的變化判斷生成物,以此書寫反應的離子方程式.
解答 解:(1)氯氣是一種黃綠色氣體,H2在Cl2中燃燒反應生成氯化氫氣體,H2+Cl2$\frac{\underline{\;點燃\;}}{\;}$2HCl,燃燒過程中發出蒼白色火焰,
故答案為:黃綠色;蒼白色;
(2)濃硫酸具有:①酸性 ②強氧化性 ③吸水性 ④脫水性,下列現象硫酸所表現出的性質為:干燥氧氣是利用濃硫酸的③吸水性,使甘蔗變黑是利用濃硫酸的④脫水性,氨氣是堿性氣體,濃硫酸吸收氨氣利用的是濃硫酸的①酸性,與銅反應生成硫酸銅、二氧化硫和水,反應娥化學方程式為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,反應中體現了濃硫酸的①酸性 ②強氧化性,
故答案為:③;④;①;①和②;Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)工業合成氨的原料為氫氣和氮氣,發生反應為:N2+3H2$\frac{\underline{\;\;催化劑\;\;}}{高溫高壓}$2NH3,實驗室是利用氯化銨和熟石灰的固體混合物加熱來制取氨氣,反應為:Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,故答案為:N2+3H2$\frac{\underline{\;\;催化劑\;\;}}{高溫高壓}$2NH3,Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)自然界中氮氣和氧氣在放電條件下反應生成一氧化氮氣體,反應的化學方程式為:N2+O2$\frac{\underline{\;放電\;}}{\;}$2NO,9.2g NO2的物質的量為,每2molNO2和Na2CO3溶液反應時轉移電子1mol,則N的化合價分別有+4價變化為+5價和+3價,在堿性溶液中應生成NO3-和NO2-,反應的離子方程式為:2NO2+CO32-=NO3-+NO2-+CO2,
故答案為:N2+O2$\frac{\underline{\;放電\;}}{\;}$2NO,2NO2+CO32-=NO3-+NO2-+CO2.
點評 本題考查了氯氣、濃硫酸、氮氧化物性質的應用,注意濃硫酸的特征性質分析和反應現象、反應產物的判斷,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1 mol | B. | 1.33 mol | C. | 2 mol | D. | 3 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
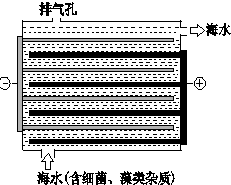 海洋化學資源的研究和合理利用具有廣闊前景,從海水中可提取氯、溴、碘等鹵族元素.
海洋化學資源的研究和合理利用具有廣闊前景,從海水中可提取氯、溴、碘等鹵族元素.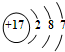 ,碘在元素周期表中的位置是第五周期ⅦA族,HI的穩定性比HBr弱(填寫“強”或“弱”).
,碘在元素周期表中的位置是第五周期ⅦA族,HI的穩定性比HBr弱(填寫“強”或“弱”).| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
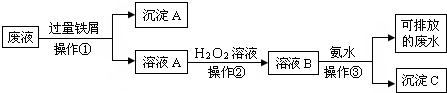
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將NaHCO3固體加入新制氯水,有無色氣泡(H+) | |
| B. | 使紅色布條褪色(Cl2) | |
| C. | 氯水能夠導電(ClO) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿性氧化物都是金屬氧化物 | |
| B. | 酸性氧化物都是非金屬氧化物 | |
| C. | NaO2能與酸反應生成鹽和水,所以 NaO2是堿性氧化物 | |
| D. | SiO2 既能和氫氧化鈉溶液反應又能和氫氟酸反應,所以是兩性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在標準狀況下,NA個水分子所占的體積約為22.4L | |
| B. | 5.6g鐵與氯氣完全反應,失去電子的數目為0.2NA | |
| C. | 1mol C12發生化學反應,轉移的電子數一定為2NA | |
| D. | 在標準狀況下,22.4L由N2、N2O組成的混合氣體中所含有的氮原子為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵片粉與稀硝酸反應:Fe+2H+═Fe2++H2↑ | |
| B. | 氧化亞鐵粉末溶于鹽酸中:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 銅與氯化鐵溶液反應:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 向硫酸鋁溶液中加入過量氨水:Al3++4OH-═AlO2+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②⑤ | B. | ①③⑤ | C. | ①③④ | D. | ③④⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com