
 某化學興趣小組用如圖所示裝置進行電化學原理的實驗探究,試回答下列問題:
某化學興趣小組用如圖所示裝置進行電化學原理的實驗探究,試回答下列問題:分析 (1)左邊是燃料電池,右邊是電解池,通氧氣的一極是正極發生還原反應,電極反應式為:O2+4e-+2H2O=4OH-;
(2)X與電源的正極相連,是陽極發生氧化反應,電解質溶液是硝酸銀溶液;
(3)粗銅中含有Zn、Fe、Ag、Au等雜質,其中鋅和鐵會在電極上放電生成陽離子進入溶液,所以陽極泥的主要成分是Ag、Au;
(4)電解飽和食鹽水陽極是氯離子失電子生成氯氣,陰極是氫離子得到電子生成氫氣;依據電解原理分析,書寫電池反應,依據生成的氣體體積,計算氫氧根離子濃度,結合離子積常數計算氫離子濃度計算溶液pH;恢復溶液濃度依據出什么,加什么的原則分析;
(5)X電極是陽極發生氧化反應,電極反應式為:2Cu+2OH--2e-=Cu2O+H2O.
解答 解:(1)A池是燃料電池,B池是電解池,通氧氣的一極是正極發生還原反應,電極反應式為:O2+4e-+2H2O=4OH-,故答案為:正;O2+4e-+2H2O=4OH-;
(2)X與電源的正極相連,是陽極發生氧化反應,所以X電極材料為銀,電解質溶液是硝酸銀溶液,故答案為:Ag;AgNO3溶液;
(3)粗銅中含有Zn、Fe、Ag、Au等雜質,其中鋅和鐵會在電極上放電生成陽離子進入溶液,所以陽極泥的主要成分是Ag、Au,故答案為:Ag、Au;
(4)Y電極與原電池的負極相連,電極氫離子得到電子生成氫氣,生成氫氣560ml的物質的量=$\frac{0.56L}{22.4L/mol}$=0.025mol,依據電解方程式:
2Cl-+2H2O=H2↑+Cl2↑+2OH-;
1 2
0.025mol n
$\frac{1}{0.025mol}=\frac{2}{n}$,解得:n=0.05mol
C(OH-)=$\frac{0.05mol}{0.5L}$=0.1mol/L,
C(H+)=$\frac{Kw}{C(O{H}^{-})}$$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,pH=-lg[H+]=13;所以應加入0.025mol×2=0.05mol的HCl恢復原狀態,
故答案為:13;0.05molHCl;
(5)X電極是陽極發生氧化反應,電極反應式為:2Cu+2OH--2e-=Cu2O+H2O,故答案為:2Cu+2OH--2e-=Cu2O+H2O.
點評 本題考查原電池、電解池工作原理,正確推斷燃料電池正負極是解本題的關鍵,難點是溶液的pH計算,根據電解飽和食鹽水的離子方程式分析解答.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
 依據氧化還原反應:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)設計的原電池如圖所示.請回答下列問題:
依據氧化還原反應:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)設計的原電池如圖所示.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(NH3)=0.010 mol/( L•s) | B. | v(O2)=0.001 mol/( L•s) | ||
| C. | v(NO)=0.001 mol/( L•s) | D. | v(H2O)=0.045 mol/( L•s) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L 1 mol/L的鹽酸中所含微粒總數約為2×6.02×1023個 | |
| B. | NaHS溶液中HS-的水解方程式為:HS-+H2O?S2-+H3O+ | |
| C. | A(s)=B(s)+C(g)△H=+86 kJ/mol能自發進行,原因是體系有自發地向混亂度增加的方向轉變的傾向 | |
| D. | 由水電離出的c(H+)=10-13mol/L的溶液中可能含有:Fe2+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
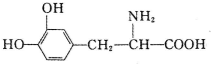
| A. | 常溫下,不溶于水 | B. | 既可與酸反應,又可與堿反應 | ||
| C. | 遇FeCl3溶液無變化 | D. | 與溴水混合,溴水褪色,溶液分兩層 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 820 | 2 750 | 11 600 |
| A. | 元素X的常見化合價是+1 | |
| B. | 元素Y是第ⅢA族元素 | |
| C. | 元素X與氯形成化合物時,化學式可能是XCl | |
| D. | 若元素Y處于第3周期,它可與冷水劇烈反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  在光照條件下驗證甲烷與氯氣的反應 在光照條件下驗證甲烷與氯氣的反應 | |
| B. |  除去甲烷中少量的乙烯得純凈甲烷 除去甲烷中少量的乙烯得純凈甲烷 | |
| C. |  制取并收集乙酸乙酯 制取并收集乙酸乙酯 | |
| D. |  分餾石油并收集60~150℃餾分 分餾石油并收集60~150℃餾分 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
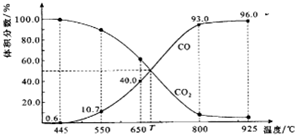 一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應:C(s)+CO2(g)?2CO(g).平衡時,體系中氣體體積分數與溫度的關系如圖所示:
一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應:C(s)+CO2(g)?2CO(g).平衡時,體系中氣體體積分數與溫度的關系如圖所示:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com