
分析 (1)葡萄糖與氫氧化銅濁液反應生成葡萄糖酸和Cu2O,葡萄糖為還原劑,被氧化;
(2)用H2O2稀硫酸共同浸泡廢印刷電路板可制備CuSO4;
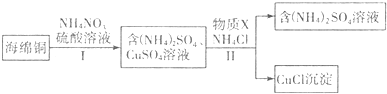
(3)海綿銅加入硫酸酸化的硝酸銨,由于酸性條件下硝酸根離子具有強氧化性,可氧化銅,加熱溫度不能太高,硝酸根離子可被還原生成氮氧化物,易導致環境污染,經步驟Ⅰ得到硫酸銨和硫酸銅溶液,經步驟Ⅱ可得到CuCl,反應中Cu元素被還原,則加入的X應具有還原性,可為銅或亞硫酸銨等還原性物質,注意盡量不要引入新雜質,經過濾可得到CuCl和硫酸銨溶液,以此解答該題.
解答 解:(1)葡萄糖中含有醛基,能夠被新制氫氧化銅氧化為羧基,化學方程式為CH2OH(CHOH)4CHO+2Cu(OH)2$\stackrel{△}{→}$CH2OH(CHOH)4COOH+Cu2O↓+2H2O,生成葡萄糖酸和Cu2O,Cu元素化合價降低,被還原,為氫氧化銅為氧化劑,葡萄糖為還原劑,被氧化,
故答案為:還原劑;
(2)正極上是元素化合價降低,得到電子發生還原反應,將反應Cu+H2O2+H2SO4=CuSO4+2H2O,其離子方程式為:Cu+H2O2+2H+=Cu2++2H2O;
故答案為:Cu+H2O2+2H+=Cu2++2H2O;
(3)海綿銅加入硫酸酸化的硝酸銨,由于酸性條件下硝酸根離子具有強氧化性,可氧化銅,因硝酸銨易分解,則加熱溫度不能太高,經步驟Ⅰ得到硫酸銨和硫酸銅溶液,經步驟Ⅱ可得到CuCl,反應中Cu元素被還原,則加入的X應具有還原性,可為銅或亞硫酸銨等還原性物質,注意盡量不要引入新雜質,經過濾可得到CuCl和硫酸銨溶液,
①加熱溫度不能太高,硝酸根離子可被還原生成氮氧化物,易導致環境污染,0.5molNH4NO3參加反應有4mol電子轉移,則N元素被還原為-3價,反應的離子方程式為4Cu+NO3-+10H+=4Cu2++NH4++3H2O;
故答案為:防止生成氮氧化物造成污染;4Cu+NO3-+10H+=4Cu2++NH4++3H2O;
②經步驟Ⅱ可得到CuCl,反應中Cu元素被還原,則加入的X應具有還原性,可為銅或亞硫酸銨等還原性物質,注意盡量不要引入新雜質,ad符合;該物質需過量以防止CuCl被氧化;
故答案為:ad;防止CuCl被氧化.
點評 本題考查物質的制備、銅的化合物的性質,側重于學生的分析能力、實驗能力和計算能力的考查,題目考查較為全面,能較好的培養學生良好的科學素養,難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | v(X)=0.005 mol•L-1•s-1 | B. | v(Z)=0.01 mol•L-1•s-1 | ||
| C. | v(Y)=0.01 mol•L-1•s-1 | D. | v(M)=0.025 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯、甲苯均不能使酸性KMnO,溶液褪色 | |
| B. | 甲烷和Cl2的反應與乙烯和Br2的反應屬于同一類型的反應 | |
| C. | C4H10有三種同分異構體 | |
| D. | 石油催化裂化的主要目的是提高汽油等輕質油的產量與質量;石油裂解的主要目的是得到更多的乙烯、丙烯等氣態短鏈烴 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 平衡不會發生移動 | B. | SO3的質量分數增大 | ||
| C. | 混合氣體的密度減小 | D. | 混合氣體的平均相對分子質量不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將鐵粉加入FeCl3、CuCl2混合溶液中,充分反應后剩余的固體中必有鐵 | |
| B. | CO2和SO2混合氣體分別通入BaCl2溶液、Ba(NO3)2溶液中,最終都有沉淀生成 | |
| C. | 鈉、鎂著火時,不可用泡沫滅火器滅火 | |
| D. | 用加熱分解的方法可將NH4Cl固體和Ca(OH)2固體的混合物分離 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  用于Cu和濃H2SO4反應制取少量的SO2氣體 | |
| B. |  用于分離水和苯的混合物 | |
| C. |  用于制備并收集NO2氣體 | |
| D. |  用于除去碳酸氫鈉固體中的少量碳酸鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 微粒的半徑:Si>Mg | B. | 氧元素不存在同素異形體 | ||
| C. | Mg的還原性強于Si | D. | 該反應是置換反應,鎂元素被氧化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com