
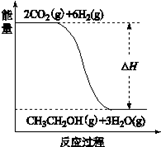
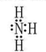 ,>
,>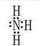 ,氧的非金屬性強于氮,所以水的穩(wěn)定性強于氨氣,填“>”
,氧的非金屬性強于氮,所以水的穩(wěn)定性強于氨氣,填“>”

科目:高中化學 來源:不詳 題型:單選題
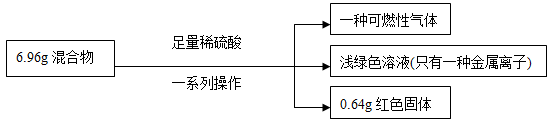
| A.生成氣體質(zhì)量為0.2g |
| B.原混合物中鐵的質(zhì)量分數(shù)無法計算 |
| C.實驗中反應的H2SO4質(zhì)量為10.78g |
| D.原混合物中銅元素的質(zhì)量不一定為0.64g |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
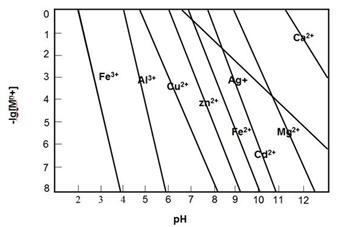
 R2Cu(有機相)+2H+(水相),已知其它陽離子與該有機物不能發(fā)生反應,也不相溶。請設計實驗方案,驗證有機相中含有銅元素。
R2Cu(有機相)+2H+(水相),已知其它陽離子與該有機物不能發(fā)生反應,也不相溶。請設計實驗方案,驗證有機相中含有銅元素。查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
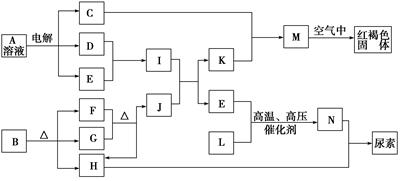
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
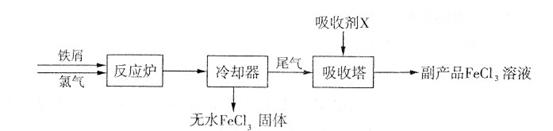
 +A。則A的化學式為 。
+A。則A的化學式為 。查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.只有①或② | B.只有②或④ |
| C.只有①或②或③ | D.上述四種物質(zhì)中任意一種 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
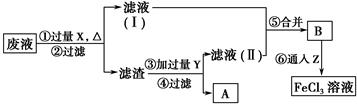
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
|
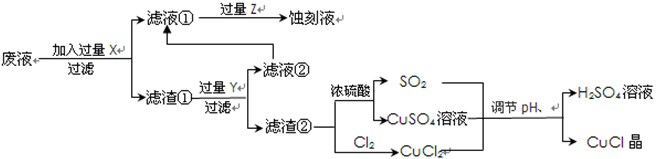 根據(jù)以上信息回答下列問題:
根據(jù)以上信息回答下列問題:| | 1 | 2 | 3 |
| 空白實驗消耗硫酸鈰標準溶液的體積(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克樣品消耗硫酸鈰標準溶液的體積(ml) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.通過化合反應可制得FeCl2和Fe(OH)3 |
| B.鐵是較活潑的金屬,不能用鐵質(zhì)容器儲存、運輸濃硝酸、濃硫酸 |
| C.不銹鋼是鐵的合金,只含金屬元素 |
| D.Fe3O4俗稱鐵紅 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com