
 .
.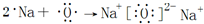 .
.分析 原子序數由小到大排列的四種短周期元素X、Y、Z、W,Y與氧元素可組成Y2O和Y2O2離子化合物,則Y為鈉元素,X、Z、W與氫元素可組成XH3、H2Z和HW共價化合物,X原子序數都小于鈉,所以X為氮元素,Z、W原子序數都大于鈉,Z為硫元素,W為氯元素,以此來答題.
解答 解:原子序數由小到大排列的四種短周期元素X、Y、Z、W,Y與氧元素可組成Y2O和Y2O2離子化合物,則Y為鈉元素,X、Z、W與氫元素可組成XH3、H2Z和HW共價化合物,X原子序數都小于鈉,所以X為氮元素,Z、W原子序數都大于鈉,Z為硫元素,W為氯元素,
(1)過氧化鈉的電子式為 ,故答案為:
,故答案為: ;
;
(2)用電子式表示Na2O的形成過程為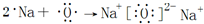 ,故答案為:
,故答案為: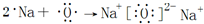 ;
;
(3)非金屬性越強,元素的最高價氧化物對應的水化物的酸性越強,在氮、硫、氯中氯元素的非金屬性最強,所以酸性最強的是HClO4,
故答案為:HClO4;
(4)NH3與H2S和HCl都能反應,生成對應的銨鹽,故答案為:NH3;
(5)由X、W組成的化合物分子中,X、W原子的最外層均達到8電子穩定結構,則該化合物為NCl3,遇水可生成一種具有漂白性的化合物為次氯酸和一種刺激性氣味的氣體則為氨氣,反應的化學方程式為NCl3+3H2O═3HClO+NH3,
故答案為:NCl3+3H2O═3HClO+NH3.
點評 本題考查位置、結構與性質的關系,為高頻考點,把握元素化合物知識推斷元素為解答的關鍵,側重分析與推斷能力、應用能力的考查,題目難度不大.


 應用題天天練四川大學出版社系列答案
應用題天天練四川大學出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | H2S的電子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-H+ | |
| B. | Mg2+的結構示意圖: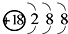 | |
| C. | Na2O的電子式:Na${\;}_{2}^{+}$[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2- | |
| D. | N2的電子式: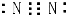 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熔點:Li>Na>K>Rb>Cs | |
| B. | 堿性:LiOH<NaOH<KOH<RbOH<CsOH | |
| C. | 與水反應的劇烈程度:Li<Na<K<Rb<Cs | |
| D. | 都能在空氣中燃燒生成R2O(R表示堿金屬) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
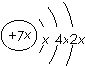 ,b與c形成化合物的電子式為
,b與c形成化合物的電子式為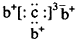 .下列比較中正確的是( )
.下列比較中正確的是( )| A. | 原子半徑:a>c>d>b | B. | 非金屬性 b>d>c | ||
| C. | 原子序數:d>a>c>b | D. | 最高價含氧酸的酸性c>d>a |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②⑤ | B. | ②③⑤ | C. | ③④⑤⑥ | D. | 全都正確 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸 | B. | NaOH固體 | C. | NaCN固體 | D. | 水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
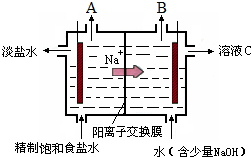 氯堿工業中電解飽和食鹽水的原理示意圖如圖所示:
氯堿工業中電解飽和食鹽水的原理示意圖如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com