
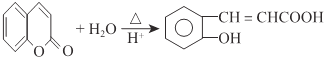
【題目】水楊酸是一種用途極廣的消毒防腐劑及醫療保養品,是合成眾多藥物的中間產物,其工業合成的路線之一如下圖所示:

已知:RCH=CHR1 RCOOH+R1COOH
RCOOH+R1COOH
請回答下列問題:
(1)B分子中含氧官能團的名稱為_________,D→水楊酸的反應類型為_________。
(2)C轉化為D的同時還有一種有機物生成,該物質的結構簡式為__________,上述轉化過程中B→C的意義是_________;在適當條件下,水楊酸可發生聚合反應生成一種高分子化合物,該化合物的結構簡式為__________。
(3)A→B的化學方程式_________。
(4)D有多種同分異構體,符合下列條件的同分異構體最多有_________種,寫出核磁共振氫譜有4個峰的物質的結構簡式____________。
①是苯的二元取代物;②能發生水解反應及銀鏡反應
(5)以1,4-二氯丁烷為基本原料制備乙二酸,寫出相應的合成路線圖(格式為反應物![]() 生成物) ____________
生成物) ____________
【答案】羥基、羧基 取代反應 HOOCCOOH 保護—OH,避免其被KMnO4溶液氧化 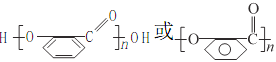
 9
9 ![]() ClCH2CH2CH2CH2Cl
ClCH2CH2CH2CH2Cl![]() CH2=CHCH=CH2
CH2=CHCH=CH2![]() HOOC—COOH
HOOC—COOH
【解析】
由C、D的組成、結構及轉化條件可推出C為![]() ,故B為
,故B為![]() ,A為
,A為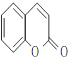 。因B中含有—OH,它易被KMnO4溶液氧化,故B→C的意義是將—OH轉化為—OCH3,避免—OH被氧化。D→水楊酸的反應中,D中—CH3被HI中的氫原子代替了,故該反應是取代反應。水楊酸通過發生酯化型的縮聚反應可得到高分子化合物。(4)由①知苯環上有兩個取代基,由于知含有酯基且酯基為甲酸酯基。兩個取代基可以分別為:—OH~—CH2OOCH、—CH2OH~—OOCH,—OCH3~OOCH。每兩個取代基在苯環上均有3種不同的位置關系,故共有9種同分異構體。核磁共振有4種峰,表明結構中存在對稱關系,由此可確定其結構簡式。(5)根據反應信息知,若要制得乙二酸,需要先制備1.3-丁二烯,故可由原料發生消去反應制得。
。因B中含有—OH,它易被KMnO4溶液氧化,故B→C的意義是將—OH轉化為—OCH3,避免—OH被氧化。D→水楊酸的反應中,D中—CH3被HI中的氫原子代替了,故該反應是取代反應。水楊酸通過發生酯化型的縮聚反應可得到高分子化合物。(4)由①知苯環上有兩個取代基,由于知含有酯基且酯基為甲酸酯基。兩個取代基可以分別為:—OH~—CH2OOCH、—CH2OH~—OOCH,—OCH3~OOCH。每兩個取代基在苯環上均有3種不同的位置關系,故共有9種同分異構體。核磁共振有4種峰,表明結構中存在對稱關系,由此可確定其結構簡式。(5)根據反應信息知,若要制得乙二酸,需要先制備1.3-丁二烯,故可由原料發生消去反應制得。
(1)A反水解反應反應生成B,結合A、B分子式可知A為環狀酯類物質,B中含有羧基、羥基,D在HI條件下發生水解反應生成水楊酸,屬于取代反應,
故答案為:羧基、羥基;取代反應;
(2)結合水楊酸的結構簡式,可知B的結構簡式為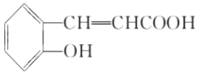 ,再結合B、C、D的轉化條件及D的結構簡式,可知C為
,再結合B、C、D的轉化條件及D的結構簡式,可知C為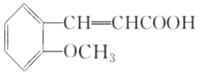 ,C氧化后另外一種有機物為乙二酸,結構簡式為HOOC-COOH.因苯環上的酚羥基易被氧化,轉化為-OCH3,保護-OH,避免其被KMnO4溶液氧化,水揚酸可發生聚合反應生成一種高分子化合物,該化合物的結構簡式為
,C氧化后另外一種有機物為乙二酸,結構簡式為HOOC-COOH.因苯環上的酚羥基易被氧化,轉化為-OCH3,保護-OH,避免其被KMnO4溶液氧化,水揚酸可發生聚合反應生成一種高分子化合物,該化合物的結構簡式為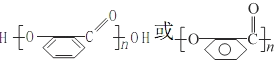 ,
,
故答案為:HOOC-COOH;保護-OH,避免其被KMnO4溶液氧化;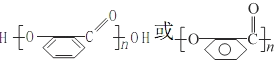 ;
;
(3)A→B發生酯的水解反應生成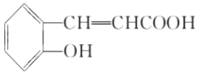 ,A的結構簡式為
,A的結構簡式為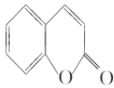 ,反應方程式為:
,反應方程式為: ,
,
故答案為: ;
;
(4)能發生水解反應及銀鏡反應,說明含有甲酸形成的酯基-OOCH,又是苯的二元取代物,2個取代基為-OOCH、-OCH3,或者為-OOCH、-CH2OH,或者為-CH2OOCH、-OH,各有鄰、間、對3種,共有9種,核磁共振氫譜有4個峰的物質的結構簡式為:![]() ,
,
故答案為:9;![]() ;
;
(5)ClCH2CH2CH2CH2Cl在氫氧化鈉醇溶液、加熱條件下發生消去反應生成CH2=CHCH=CH2,然后堿性高錳酸鉀溶液氧化,并酸化得到HOOC-COOH,故答案為:ClCH2CH2CH2CH2Cl![]() CH2=CHCH=CH2
CH2=CHCH=CH2![]() HOOC—COOH。
HOOC—COOH。


科目:高中化學 來源: 題型:
【題目】如圖所示,室溫下分別向密閉容器內可移動活塞的兩邊充入空氣(已知空氣體積占整個容器容積的1/4)、H2 和O2 的混合氣體,若將H2、O2 的混合氣體點燃引爆。活塞先左彈,恢復室溫后,活塞右滑停留于容器的中央。則原來H2、O2 的物質的量之比可能為①4∶5 ② 2∶5 ③3∶8 ④7∶2
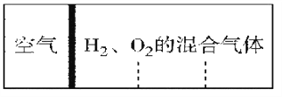
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵(26Fe)、鈷(27Co)兩種元素均為第四周期元素,它們的用途極為廣泛。回答:
(1)26Fe位于元素周期表的第______縱行。
(2)為比較相同濃度的FeCl3溶液和CuSO4溶液對H2O2分解的催化效果,某研究小組進行了如下探究:
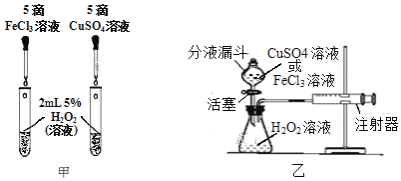
①如圖甲,可通過觀察______來定性比較兩者的催化效果。
②如圖乙,要定量比較兩者的催化效果,可測量生成等體積氣體所需的______。
③在FeCl3溶液中,究竟是哪種粒子起催化作用?
猜想1:鐵離子(Fe3+)起催化作用;
猜想2:______起催化作用;猜想3:______起催化作用;……
若要驗證猜想1成立,只需要在圖甲的兩只試管中分別加入同濃度、同體積的______和______,再通過觀察現象,即可證明猜想1成立。
(3)請仔細閱讀、分析下列有關利用鈷渣[含Co(OH)3、Fe(OH)3等]制備鈷氧化物的工藝流程圖,回答下列問題:
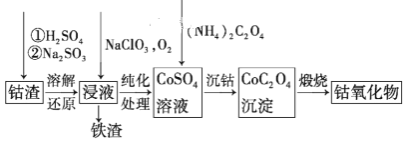
鐵渣中鐵元素的化合價為______,在空氣中煅燒CoC2O4(草酸鈷,其中碳為+3價),生成鈷氧化物和CO2,測得充分煅燒后固體質量為2.41g,CO2的體積為1.344L(標準狀況),則鈷氧化物的化學式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列依據熱化學方程式得出的結論正確的是( )
A. 已知2H2(g)+O2(g)=2H2O(l)△H=﹣483.6 kJmol﹣1,則氫氣的燃燒熱為483.6 kJmol﹣1
B. 在一定溫度和壓強下,將0.5mol N2和1.5 mol H2置于密閉容器中充分反應生成NH3(g),放出熱量19.3 kJ,則其熱化學方程式為N2(g)+3H2(g)![]() 2NH3(g) △H=﹣19.3kJ/mol
2NH3(g) △H=﹣19.3kJ/mol
C. 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 則△H1>△H2
D. 已知Ni(CO)4(s)=Ni(s)+4CO(g) △H=Q kJmol﹣1,則Ni(s)+4CO(g)=Ni(CO)4(s) △H=﹣Q kJmol﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是一種重要的化工原料,自來水消毒、農藥的生產、藥物的合成等都需要用到氯氣。
I.工業上通常采用電解法制氯氣:觀察下圖,回答:
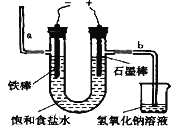
(1)通電后,_____(填“鐵棒”或“石墨棒”)電極上產生氯氣,若飽和食鹽水中含有酚酞,______(填“a”或“b”)側先變紅。
(2)寫出該電解反應的化學方程式為_______________________________________。
(3)該裝置中,NaOH溶液的作用是____________________________。
II.在實驗室中用二氧化錳跟濃鹽酸反應制備干燥純凈的氯氣。進行此實驗,所用儀器如下圖:

(1)連接上述儀器的正確順序是:E→_______→________→_______→_______→H→G→F。
(2)氣體發生裝置中進行的反應化學方程式是________________________________;若在標準狀態下收集到4.48 L氯氣,則被氧化的HCl的物質的量是_______mol。
(3)上面裝置中飽和食鹽水的作用是__________________。
(4)將新制氯水滴到pH試紙上,現象為_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學反應的離子方程式中正確的是
A.向Ca(HCO3)2溶液加入過量的NaOH溶液:![]()
B.向NH4HCO3溶液中滴入少量NaOH溶液:![]()
C.澄清石灰水與少量小蘇打溶液混合::![]()
D.少量氫氧化鋇溶液與過量硫酸氫鈉混合:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于在一個密閉容器中進行的反應C(s)+H2O(g) ![]() CO(g)+H2(g) ,下列條件的改變對反應速率幾乎沒有影響的是
CO(g)+H2(g) ,下列條件的改變對反應速率幾乎沒有影響的是
①增加C的量; ②增加CO的量;
③將容器的體積縮小一半; ④保持體積不變,充入N2以增大壓強;
⑤升高反應體系的溫度; ⑥保持壓強不變,充入N2以增大體積。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】影響化學反應速率的因素很多,某化學小組用實驗的方法進行探究。
I.探究活動一:
備選藥品:鐵片、鋅片、0.5mol/LH2SO4、1.5mol/LH2SO4、18.4mol/LH2SO4
甲同學研究的實驗報告
實驗步驟 | 現象 | 結論 |
①分別取等體積的1.5mol/L的硫酸于兩支試管中; ②_____________________。 | 反應速率: 鋅>鐵 | 金屬的性質越活潑,反應速率越快 |
(1)甲同學實驗報告中的實驗步驟②為__________________________________。
(2)甲同學的實驗目的是_______________________________;要得出正確的實驗結論,還需控制的實驗條件是__________________。
乙同學為了定量研究濃度對化學反應速率的影響,利用如圖所示裝置進行實驗:

(3)乙同學在實驗中需要測定的數據是_________________________。
(4)乙同學不會選用___________mol/L硫酸完成該實驗,理由是_________________。
II.探究活動二:
備選藥品:0.1mol/LNa2S2O3溶液、0.2mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.2mol/LH2SO4溶液。
已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
實驗 編號 | Na2S2O3用量 | H2SO4用量 | 溫度(℃) |
① | 0.1mol/L5mL | 0.1mol/L5mL | 10 |
② | 0.2mol/L5mL | 0.2mol/L5mL | 25 |
③ | 0.1mol/L5mL | 0.1mol/L5mL | 25 |
④ | 0.1mol/L5mL | 0.1mol/L5mL | 40 |
(1)若想探究溫度對化學反應速率的影響,可選的實驗編號有___________。
(2)若想探究濃度對化學反應速率的影響,可選的實驗編號有___________。
(3)在該實驗過程中,需要觀察和記錄________________,來比較化學反應速率的快慢。
(4)Na2S2O3在堿性溶液中可被I2氧化為Na2SO4,寫出該反應的離子方程式___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】藥物中間體Q、醫用材料PVA的合成路線如圖。
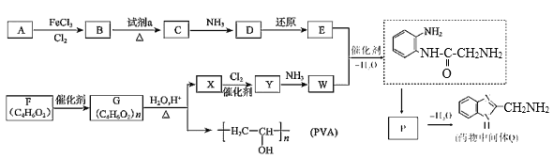
已知:①R-Cl+2NH3→R-NH2+NH4Cl
②R-NO2![]() R-NH2
R-NH2
③-NH2+![]()
(1)A的分子式是________。
(2)B→C是硝化反應,試劑a是________(填名稱)。
(3)C→D轉化的化學方程式是________。
(4)E的結構簡式是________。
(5)F含有的官能團是________(填名稱),與其含有相同官能團的同分異構體還有________種。
(6)G→X的化學方程式是________。
(7)W能發生縮聚反應,形成的高分子結構簡式是________。
(8)P的結構簡式是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com