
【題目】氮(N)、磷(P)、砷(As)等ⅤA元素化合物在研究和生產中有重要用途。如我國科研人員研究發現As2O3或寫成As4O6,俗稱砒霜)對白血病有明顯的治療作用。回答下列問題:
(1)As原子的簡化的核外電子排布式為_____;P的第一電離能比S大的原因為________。
(2)寫出一種與CN-互為等電子體的分子___(用化學式表示);(SCN)2分子中σ鍵和π鍵個數比為__。
(3)砒霜劇毒,可用石灰消毒生成AsO33-少量AsO43-,其中AsO33-中As的雜化方式為___,AsO43-的空間構型為___。
(4)NH4+中H-N-H鍵角比NH3中H-N-H的鍵角大的原因是____;NH3和水分子與銅離子形成的化合物中陽離子呈軸向狹長的八面體結構(如圖Ⅰ),該化合物加熱時首先失去水,請從原子結構角度加以____。
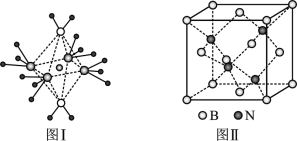
(5)BN的熔點為3000℃,密度為2.25g/cm3,其晶胞結構如上圖Ⅱ所示,晶體中一個B原子周圍距離最近的N原子有____個;若原子半徑分別為rN和rB,阿伏加德羅常數值為NA,則BN晶胞中原子的體積占晶胞體積的百分率為_____。
【答案】1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 P的p能級是半充滿狀態,比較穩定,所以第一電離能比硫大 CO或N2 5:4 sp3 正四面體 NH4+的氮原子上均為成鍵電子,而NH3分子中的氮原子上有一對孤對電子,孤對電子與成鍵電子之間的排斥力強于成鍵電子與成鍵電子之間的排斥力,導致NH4+中H-N-H鍵角比NH3中大 由于O原子半徑小,電負性大,提供孤對電子能力比N原子弱,故水分子形成的配位鍵弱于氨分子 4 ![]() ×100%
×100%
【解析】
(1)As原子核外有33個電子,根據構造原理判斷核外電子排布。第ⅤA族元素最外層p軌道是半充滿狀態,比相鄰主族元素第一電離能大;
(2)CN-原子數為2,價電子數為10,找等電子體可用“替代法”;(SCN)2的結構式為N![]() C—S—S—C
C—S—S—C![]() N,根據結構式找σ鍵和π鍵個數;
N,根據結構式找σ鍵和π鍵個數;
(3)先計算AsO33-中As上的孤電子對數,成鍵電子對數等于配對原子數,As的價層電子對數=孤電子對數+成鍵電子對數,然后分析雜化方式和空間構型;
(4)孤對電子與成鍵電子之間的排斥力強于成鍵電子與成鍵電子之間的排斥力,這是導致鍵角大小的原因;加熱時首先失去水,說明水分子與Cu2+形成的配位鍵弱于NH3分子,然后分析水分子形成的配位鍵弱于氨分子原因即可;
(5)根據晶胞圖判斷一個N原子周圍距離最近的B原子有多少個;用“均攤法”求B原子個數和N原子個數,然后求出晶胞中原子的體積占晶胞體積的百分比就是空間利用率。
(1)As原子核外有33個電子,根據構造原理,As原子的核外電子排布式為1s22s22p63s23p63d104s24p3或[Ar] 3d104s24p3。P和S都處于第三周期,S的價電子排布式為3s23p4,P的價電子排布式為3s23p3,P的3p能級處于半充滿,比較穩定,P的第一電離能比S的大;答案:1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;P的p能級是半充滿狀態,比較穩定,所以第一電離能比硫大;
(2)用“替代法”,與CN-互為等電子體的粒子有CO、N2、C22-等;(SCN)2的結構式為N![]() C—S—S—C
C—S—S—C![]() N,單鍵全是σ鍵,三鍵中有1個σ鍵和2個π鍵,(SCN)2分子中有5個σ鍵、4個π鍵,σ鍵和π鍵個數比為5:4;答案:CO或N2、5:4;
N,單鍵全是σ鍵,三鍵中有1個σ鍵和2個π鍵,(SCN)2分子中有5個σ鍵、4個π鍵,σ鍵和π鍵個數比為5:4;答案:CO或N2、5:4;
(3)AsO33-中As上的孤電子對數=![]() (5+3-3
(5+3-3![]() 2)=1,成鍵電子對數為3,As的價層電子對數為1+3=4,As的雜化方式為sp3雜化;AsO43-中As上的孤電子對數=
2)=1,成鍵電子對數為3,As的價層電子對數為1+3=4,As的雜化方式為sp3雜化;AsO43-中As上的孤電子對數=![]() (5+3-4
(5+3-4![]() 2)=0,成鍵電子對數為4,As的價層電子對數為0+4=4,AsO43-的VSEPR模型為正四面體,由于沒有孤電子對,AsO43-的空間構型為正四面體;答案: sp3;正四面體;
2)=0,成鍵電子對數為4,As的價層電子對數為0+4=4,AsO43-的VSEPR模型為正四面體,由于沒有孤電子對,AsO43-的空間構型為正四面體;答案: sp3;正四面體;
(4)NH4+中H—N—H的鍵角比NH3中H—N—H
(5)用“均攤法”,B:8![]() +6
+6![]() =4,N:4,該晶體的化學式為BN,根據晶胞,晶體中一個N原子周圍距離最近的B原子有4個,則一個B原子周圍距離最近的N原子有4個。一個晶胞中原子的體積為4
=4,N:4,該晶體的化學式為BN,根據晶胞,晶體中一個N原子周圍距離最近的B原子有4個,則一個B原子周圍距離最近的N原子有4個。一個晶胞中原子的體積為4![]() (
(![]() πrN3+
πrN3+![]() πrB3)pm3=4
πrB3)pm3=4![]() (
(![]() πrN3+
πrN3+![]() πrB3)
πrB3)![]() 10-30cm3,1mol晶體的質量為25g,1mol晶體的體積為25g
10-30cm3,1mol晶體的質量為25g,1mol晶體的體積為25g![]() 2.25g/cm3,晶胞的體積為4
2.25g/cm3,晶胞的體積為4![]() (25g
(25g![]() 2.25g/cm3
2.25g/cm3![]() NA),BN晶胞中原子的體積占晶胞體積的百分率為4
NA),BN晶胞中原子的體積占晶胞體積的百分率為4![]() (
(![]() πrN3+
πrN3+![]() πrB3)
πrB3)![]() 10-30cm3
10-30cm3![]() [4
[4![]() (25g
(25g![]() 2.25g/cm3
2.25g/cm3![]() NA)]=
NA)]=![]() ×100%;答案:
×100%;答案:![]() ×100%。
×100%。


 優翼小幫手同步口算系列答案
優翼小幫手同步口算系列答案科目:高中化學 來源: 題型:
【題目】圖所示與對應敘述相符的是
A. 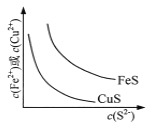 表示一定溫度下FeS和CuS的沉淀溶解平衡曲線,則Ksp(FeS) <Ksp(CuS)
表示一定溫度下FeS和CuS的沉淀溶解平衡曲線,則Ksp(FeS) <Ksp(CuS)
B. 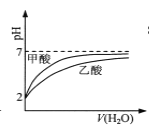 pH=2的甲酸與乙酸溶液稀釋時的pH變化曲線,則酸性:甲酸<乙酸
pH=2的甲酸與乙酸溶液稀釋時的pH變化曲線,則酸性:甲酸<乙酸
C. 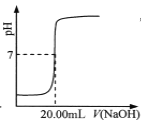 表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL鹽酸的滴定曲線,則 c(HCl)=0.0800 mol ·L-1
表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL鹽酸的滴定曲線,則 c(HCl)=0.0800 mol ·L-1
D. 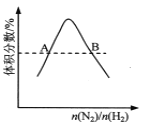 反應N2(g)+3H2(g)
反應N2(g)+3H2(g) ![]() 2NH3(g)平衡時NH3體積分數隨起始n(N2)/n(H2)變化的曲線,則轉化率:αA(H2)=αB(H2)
2NH3(g)平衡時NH3體積分數隨起始n(N2)/n(H2)變化的曲線,則轉化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國古代四大發明之一黑火藥,它的爆炸反應為:S +2KNO3+3C ﹦ A+N2↑+3CO2↑(已配平)
(1)除S外,上述元素的電負性從小到大依次為_______。除K、S外第一電離能從大到小的順序為______________。
(2)在生成物中,A為______化合物,CO2為_______化合物(填“離子化合物”或共價化合物),含極性共價鍵的分子的中心原子軌道雜化類型為______________。
(3)CN﹣與N2互為______,寫出CN﹣的電子式________。推算HCN分子中σ鍵與π鍵數目之比_________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二茂鐵分子[Fe (C5H5)2]是一種金屬有機配合物,是燃料油的添加劑,用以提高燃燒的效率和去煙,可作為導彈和衛星的涂料等。它的結構如圖所示,下列說法正確的是( )
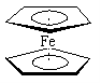
A.二茂鐵中Fe2+與環戊二烯離子(C5H5-)之間為離子鍵
B.1mol環戊二烯(![]() )中含有σ鍵的數目為5NA
)中含有σ鍵的數目為5NA
C.二茂鐵分子中存在π鍵
D.Fe2+的電子排布式為1s22s22p63s23p63d44s2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現以淀粉或乙烯為主要原料都可以合成乙酸乙酯,其合成路線如圖所示。

(已知:2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
(1)A中含有的官能團名稱是______________;其中③的反應類型是______________;
⑥的反應類型是______________;
(2)寫乙烯的電子式:_________________乙烯的結構簡式:____________;
(3)寫出下列反應的化學方程式:①__________________;⑤______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】K3[Fe(C2O4)3]·3H2O(三草酸合鐵酸鉀)為亮綠色晶體,可用于曬制藍圖。回答下列問題:
(1)曬制藍圖時,用K3[Fe(C2O4)3]·3H2O作感光劑,以K3[Fe(CN)6]溶液為顯色劑。其光解反應的化學方程式為:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;顯色反應的化學方程式為______________。
2FeC2O4+3K2C2O4+2CO2↑;顯色反應的化學方程式為______________。
(2)某小組為探究三草酸合鐵酸鉀的熱分解產物,按下圖所示裝置進行實驗。
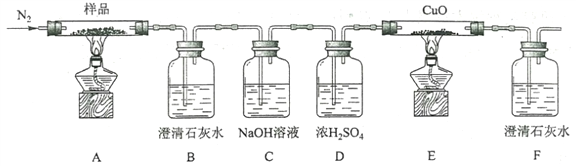
①通入氮氣的目的是________________________________________。
②實驗中觀察到裝置B、F中澄清石灰水均變渾濁,裝置E中固體變為紅色,由此判斷熱分解產物中一定含有___________、___________。
③為防止倒吸,停止實驗時應進行的操作是_____________________________。
④樣品完全分解后,裝置A中的殘留物含有FeO和Fe2O3,檢驗Fe2O3存在的方法是:________________。
(3)測定三草酸合鐵酸鉀中鐵的含量。
①稱量m g樣品于錐形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至終點。滴定終點的現象是___________________________。
②向上述溶液中加入過量鋅粉至反應完全后,過濾、洗滌,將濾液及洗滌液全部收集到錐形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至終點,消耗KMnO4溶液V mL。該晶體中鐵的質量分數的表達式為________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式中,正確的是( )
A.碳酸氫銨溶液中加入足量的濃氫氧化鈉溶液并加熱:NH4++OH- =NH3↑+H2O
B.銅與稀硝酸的反應:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.過量二氧化硫與氫氧化鈉溶液反應:SO2+OH- =HSO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】采用乙烯與甲苯為主要原料,按下列路線可合成有機物E、F:

已知:![]()
請回答:
(1)B中官能團的名稱是_________,反應⑥的反應類型是__________。
(2)F的結構簡式___________________________。
(3)D→E的化學方程式_________________________________。
(4)下列有關說法不正確的是_________。
A.E能與新制的Cu(OH)2懸濁液發生反應,而B不能與新制的Cu(OH)2懸濁液發生反應
B.![]() 不能使酸性KMnO4溶液褪色
不能使酸性KMnO4溶液褪色
C.1molE和足量H2反應,最多消耗4molH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A、B、C、D、E都是周期表中前四周期的元素,它們的核電荷數A<B<C<D<E。其中A、B、C是同一周期的非金屬元素。AC2是非極性分子。B、C的氫化物的沸點比它們同族相鄰周期元素氫化物的沸點高。E的原子序數為24,ECl3能與B、C的氫化物形成六配位的配合物,且兩種配體的物質的量之比為2:1,三個氯離子在外界。根據以上情況,回答下列問題:(答題時,A、B、C、D、E用所對應的元素符號表示)
(1)A、B、C的第一電離能由小到大的順序為_________;
(2)B的氫化物的分子立體構型是_____;其中心原子采取_______雜化。
(3)寫出化合物AC2的電子式為_______;一種由B、C組成的化合物與AC2互為等電子體,其化學式為______。
(4)E的核外電子排布式是______,ECl3形成的配合物的化學式為_____
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com