
分析 (1)根據v=$\frac{△c}{△t}$計算反應速率;
(2)根據反應中各物質的變化的物質的量之比等于計量數之比,可寫出化學方程式;
(3)根據影響化學反應速率和化學平衡的條件可作判斷;
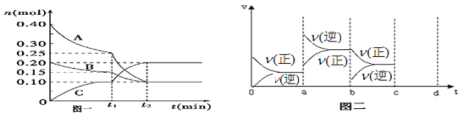
解答 解:(1)t1=10min,0至t1時間內B物質的平均反應速率v=$\frac{△c}{△t}$=$\frac{\frac{0.20mol-0.15mol}{10L}}{10min}$=5.0×10-4mol-1min-1,故答案為:5.0×10-4mol-1min-1;
(2)根據圖一可知,A、B的物質的量在減小,為反應物,C的物質的量增加,為生成物,且有△n(A)=0.40mol-0.10mol=0.30mol,△n(B)=0.20mol-0.10mol=0.10mol,△n(C)=0.20mol-0mol=0.20mol,再根據反應中各物質的變化的物質的量之比等于計量數之比,可寫出化學方程式為3A(g)+B(g)?2C(g),
故答案為:3A(g)+B(g)?2C(g);
(3)根據圖二可知,在a時刻,正逆反應速率都增大,且逆反應速率大于正反應速率,即平衡逆向移動,因為反應的△H<0,根據影響化學反應速率和化學平衡的條件可知,a~b過程中改變的條件可能是升溫;在b時刻,正反應速率 不變,逆反應速率減小,且正反應速率大于逆反應速率,即平衡正向移動,根據影響化學反應速率和化學平衡的條件可知,b~c過程中改變的條件可能是減小生成物C的濃度,故答案為:升溫,減小生成物C的濃度.
點評 本題考查了根據圖象寫化學方程式、計算反應速率及影響反應速率和化學平衡移動的外界因素等知識,難度不大,在看圖二時要注間線的起點和正逆反應速率的相對大小,進而判斷平衡移動方向.


 快樂小博士鞏固與提高系列答案
快樂小博士鞏固與提高系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol/L NaB溶液中水電離的OH-濃度大于10-7 mol/L | |
| B. | NaB溶液中:c(Na+)>c(B-)>c(H+)>c(OH-) | |
| C. | NaB溶液中:c(Na+)+c(H+)=c(HB)+c(B-) | |
| D. | HB的電離方程式為:HB═H++B- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 在一定條件下,在容積不變的密閉容器內進行反應:2NO+2CO?N2+2CO2 △H<0.曲線a表示NO的轉化率與反應時間的關系,若改變初始條件,使反應過程按照曲線b進行,可采取的措施是( )
在一定條件下,在容積不變的密閉容器內進行反應:2NO+2CO?N2+2CO2 △H<0.曲線a表示NO的轉化率與反應時間的關系,若改變初始條件,使反應過程按照曲線b進行,可采取的措施是( )| A. | 加催化劑 | B. | 降低溫度 | C. | 增大NO的濃度 | D. | 縮小容器體積 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉、鎂等金屬著火,不可用CO2滅火 | |
| B. | 在氣體發生裝置上點燃氫氣等氣體時,必須先檢驗氣體的純度 | |
| C. | 實驗結束后將所有的廢液倒入下水道排出實驗室,以免污染實驗室 | |
| D. | 給試管中的液體加熱時,不停沿試管傾斜方向移動試管或加入碎瓷片,以免液體暴沸傷人 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣能與大多數金屬化合,其一般將變價金屬氧化至最高價 | |
| B. | 干燥的氯氣和氯水均能使鮮花褪色 | |
| C. | 除去氯氣中少量氯化氫可使氣體通過飽和食鹽水 | |
| D. | 因為氯氣有毒,所以可用于殺菌、消毒、漂白 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com