
【題目】下列各組中的離子,能在溶液中共存的是( )
A.K+、H+、SO42﹣、OH﹣
B.Na+、Ca2+、CO32﹣、NO3﹣
C.Na+、H+、Cl﹣、CO32﹣
D.Na+、Cu2+、Cl﹣、SO42﹣
科目:高中化學 來源: 題型:
【題目】三鹽(3PbO·PbSO4·H2O)可用作聚氯乙烯的熱穩定劑,200℃以上開始失去結晶水,不溶于水及有機溶劑。以200.0t鉛泥(主要成分為PbO、Pb及PbSO4等)為原料制備三鹽的工藝流程如圖所示。

已知:PbSO4和PbCO3的溶解度和溶度積Ksp如下表。

(1)步驟①轉化的目的是_______,濾液1中的溶質為Na2CO3和_______(填化學式)。
(2)步驟③酸溶時,為提高酸溶速率,可采取的措施是_________(任寫一條)。其中鉛與硝酸反應生成Pb(NO3)2和NO的離子方程式為__________________。
(3)濾液2中可循環利用的溶質的化學式為_______。若步驟④沉鉛后的濾液中c(Pb2+)=1.82×10-5mol/L,則此時c(SO42-)=______mol/L。
(4)步驟⑦洗滌操作時,檢驗沉淀是否洗滌完全的方法是________________。
(5)步驟⑥合成三鹽的化學方程式為____________,若得到純凈干燥的三鹽99.Ot,假設鉛泥中的鉛元素有80%轉化為三鹽,則鉛泥中鉛元素的質量分數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、X、Y和Z是原子序數依次遞增的短周期元素,其中A與Y同主族,X與Z同主族,A與B和X均可形成10個電子的化合物;B與Z的最外層電子數之比為 2:3,常見化合物Y2X2與水反應生成X的單質,其水溶液可使酚酞試液變紅。請回答下列問題:
(1)Z的原子結構示意圖為___________________________;
(2)化合物Y2X2中含有的化學鍵類型有____________(填序號)。
A.離子鍵 B.極性共價鍵 C.非極性鍵 D.氫鍵
(3)A與X和A與Z均能形成18個電子的化合物,此兩種化合物發生反應的化學方程式為: ______________________________________________。
(4)將Z與X形成的氣態化合物ZX2通入Ba(NO3)2溶液中,有白色沉淀和一氧化氮氣體生成,發生反應的離子方程式為:___________________________________________。
(5)由BA4、X2、YXA溶液可以組成原電池,則組成該原電池的負極反應式為:_____________________,
原電池工作一段時間后,整個溶液的pH將__________(填“增大”、“不變”或“減小”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】選用一種試劑除去下列各物質中的雜質(括號內為雜質),把所選試劑的化學式填在橫線上,并寫出離子方程式。
(1)BaCl2(HCl)試劑 ;離子方程式為 ;
(2)CO(CO2)試劑 ;離子方程式為 ;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關生物體內化合物的敘述,正確的是( )
A. 淀粉、糖原和纖維素水解得到的單體相同
B. 種子從休眠進入萌發狀態,結合水/自由水比值上升
C. 人體內的脂肪能貯存能量、調節代謝
D. 無機鹽在人體中都以離子狀態存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.室溫下,將一元酸HA的溶液和KOH溶液等體積混合(忽略混合后溶液的體積變化),實驗數據如下表:
實驗序號 | 起始濃度/(mol·L-1) | 反應后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
請回答:
(1)HA溶液和KOH溶液反應的離子方程式為________。
(2)實驗①反應后的溶液中由水電離出的c(OH-)=________mol·L-1;x________0.2mol·L-1(填“>”“<”或“=”)。
(3)下列關于實驗②反應后的溶液說法不正確的是________(填字母)。
a.溶液中只存在著兩個平衡
b.溶液中:c(A-)+c(HA)>0.1mol·L-1
c.溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氫氧燃料電池以疏松多孔石墨棒為電極,KOH溶液為電解質溶液。
(4)寫出該電池工作時負極的電極反應式________。
(5)若該氫氧燃料電池每釋放228.8kJ電能時,會生成1mol液態水,則該電池的能量轉化率為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,分別取“銀鏡反應”(少許葡萄糖與過量銀氨溶液作用)過濾后的剩余溶液,并向其中加入指定物質,反應后的溶液中主要存在的一組離子(有機物除外)正確的是
A. 通入過量的NH3(g): Ag+、NH4+、NO3-、OH-
B. 加入過量 HNO3(aq): NH4+、Ag+、H+、NO3-、
C. 通入過量 HCl(g): [Ag(NH3)2]+、NH4+、H+、Cl-、NO3-、
D. 加入過量NaOH(aq): [Ag(NH3)2]+、NH4+、Na+、NO3-、OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹽酸和氫氧化鈉是工業上重要的化工原料,也是實驗室里常見的試劑.
Ⅰ.測定中和熱.
寫出稀鹽酸和稀氫氧化鈉溶液反應表示中和熱的熱化學方程式__________________________
(中和熱數值為57.3kJ/mol):
(2)取50mL 0.5mol/L HCl溶液與50mL0.55mol/L NaOH溶液進行測定,但實驗數值小于57.3kJ/mol,原因不可能是_______________(填序號).
A.用溫度計測定NaOH溶液起始溫度后直接測定鹽酸的溫度
B.量取鹽酸的體積時仰視讀數
C.分多次把NaOH溶液倒入盛有鹽酸的小燒杯中
D.實驗裝置保溫、隔熱效果差
Ⅱ.酸堿中和滴定.
欲測定某NaOH溶液的物質的量濃度,可用0.1000 mol·L-1 HCl標準溶液進行中和滴定(用酚酞作指示劑)。請回答下列問題:
(1)若甲學生在實驗過程中,記錄滴定前滴定管內液面讀數為1.10 mL,滴定后液面如圖,則此時消耗標準溶液的體積為_________________。

(2)乙學生做了三組平行實驗,數據記錄如下:
實驗序號 | 待測NaOH溶液的體積/mL | 0.1000mol·L-1HCl溶液的體積/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
選取上述合理數據,計算出待測NaOH溶液的物質的量濃度為________________(小數點后保留四位)。
(3)下列哪些操作會使測定結果偏高___________(填序號)。
A.錐形瓶用蒸餾水洗凈后再用待測液潤洗
B.酸式滴定管用蒸餾水洗凈后再用標準液潤洗
C.滴定前酸式滴定管尖端氣泡未排除,滴定后氣泡消失
D.滴定前讀數正確,滴定后俯視滴定管讀數
滴定終點的判斷__________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人口資源環境委員會副主任、中國科學院院士秦大河表示,當前情況下散燒煤和沒有清潔的煤是造成中國城市霧霾或者東部霧霾的主要原因。煤的氣化是解決霧霾,清潔地利用煤炭的重要途徑之一。
⑴已知:H2O(g)=H2O(I) △H=-44kJ/mol
物質 | H2(g) | C(s) | CO(g) |
燃燒熱kJ/mol | -285.8 | -393.5 | -283.0 |
①請寫出煤的氣化反應生成合成氣(CO和H2)的熱化學方程式___________。
②在恒溫、恒容的反應器中,能表明上述反應達到平衡狀態的是_______。
a.混合氣體平均相對分子質量不再改變
b.氣體壓強不再改變
c.各氣體濃度相等
d.反應體系中溫度保持不變
e.斷裂氫氧鍵速率是斷裂氫氫鍵速率的2倍
f.混合氣體密度不變
g.單位時間內,消耗水的質量與生成氫氣的質量比為9:1
⑵在催化劑作用下合成氣合成甲烷過程中會發生如下反應:
I CO(g)+3H2(g) = CH4(g)+H2O(g) △H1= -206 kJ/mol
II CO(g)+H2O(g) = CO2(g)+H2(g) △H2= -41 kJ/mol
Ⅲ 2CO(g)+2H2(g)= CH4(g)+CO2(g) △H 3= -247.4 kJ/mol
①圖1是太原理工大學煤化工研究所利用熱力學數據分析得到溫度對反應ⅠInK(化學平衡常數K的自然對數)的曲線圖,請分析出現這樣趨勢的原因是____________。
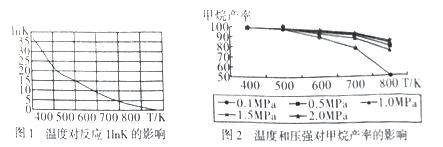
②提高甲烷反應選擇性的關鍵因素是_______,根據相關知識和圖2分析合成甲烷適宜的反應條件是
在550~630K,1MPa的原因是__________________。
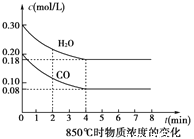
③850℃時在體積為5L反應器中發生反應Ⅱ,CO和H2O(g)濃度變化如圖所示,請列式計算此條件下的平衡常數_____________ 。
(3)CH4燃料電池利用率很高,裝置中添加1L2mol/L的KOH溶液為電解質,持續緩慢通入標準狀況下甲烷22.4L~33.6 L時負極電極反應為___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com