
【題目】電解原理在化學工業中有廣泛應用.如圖表示一個電解池,裝有電解液a;X,Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題: 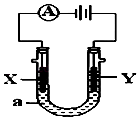
(1)若X,Y都是惰性電極,a是NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則:
①Y電極上的電極反應式為 . 在X極附近觀察到的現象是:
檢驗Y電極產物的方法是:
②電解總反應離子方程式為 .
(2)若X和Y仍均為惰性電極,a為CuSO 4 溶液,則電解時的化學反應方程式為
. 通過一段時間后,向所得溶液中加入16g CuO粉末,恰好恢復到電解前的濃度和pH,則電解過程中轉移的電子的物質的量為 .
(3)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,則
①X電極的材料是
②Y電極的電極反應式是(說明:雜質發生的電極反應不必寫出)
③假若電路中有0.04摩爾電子通過時,陰極增重克.
【答案】
(1)2Cl﹣﹣2e﹣=Cl2↑;有氣泡產生,溶液變紅;將濕潤的淀粉碘化鉀試紙接近出氣口,如果試紙變藍色就說明生成氯氣;2Cl﹣+2H2O ![]() 2OH﹣+Cl2↑+H2↑
2OH﹣+Cl2↑+H2↑
(2)2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4;多余;0.4mol
2Cu+O2↑+2H2SO4;多余;0.4mol
(3)純銅;Cu2++2e﹣=Cu;1.28
【解析】解:(1)①若X、Y都是惰性電極,a是飽和NaCl溶液,Y電極上氯離子放電生成氯氣,電極反應式為2Cl﹣﹣2e﹣=Cl2↑,氯氣具有氧化性,能氧化碘離子生成碘單質,碘遇淀粉試液變藍色,所以氯氣可以用濕潤的淀粉碘化鉀試紙檢驗;X電極上氫離子放電,同時該電極附近生成氫氧根離子,所以在X極附近觀察到的現象是有氣泡產生,溶液變紅,
所以答案是:2Cl﹣﹣2e﹣=Cl2↑;有氣泡產生,溶液變紅;將濕潤的淀粉碘化鉀試紙接近出氣口,如果試紙變藍色就說明生成氯氣;
②X電極上氫離子放電,同時該電極附近生成氫氧根離子,Y電極上氯離子放電生成氯氣,所以電池反應式為2Cl﹣+2H2O ![]() 2OH﹣+Cl2↑+H2↑,所以答案是:2Cl﹣+2H2O
2OH﹣+Cl2↑+H2↑,所以答案是:2Cl﹣+2H2O ![]() 2OH﹣+Cl2↑+H2↑;(2)若X和Y仍均為惰性電極,a為CuSO4溶液,則電解時的總化學反應方程式為2CuSO4+2H2O
2OH﹣+Cl2↑+H2↑;(2)若X和Y仍均為惰性電極,a為CuSO4溶液,則電解時的總化學反應方程式為2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4 , 通電一段時間后,向所得溶液中加入16gCuO粉末,物質的量=
2Cu+O2↑+2H2SO4 , 通電一段時間后,向所得溶液中加入16gCuO粉末,物質的量= ![]() =0.2mol,恰好恢復到電解前的濃度和pH,則生成的硫酸為0.2mol,反應的硫酸銅物質的量為0.2mol,轉移電子0.4mol,所以答案是:2CuSO4+2H2O
=0.2mol,恰好恢復到電解前的濃度和pH,則生成的硫酸為0.2mol,反應的硫酸銅物質的量為0.2mol,轉移電子0.4mol,所以答案是:2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4;0.4mol;(3)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,陽極應該是粗銅、陰極是純銅,則X電極是純銅、Y電極是粗銅,陰極上銅離子放電,電極反應式為Cu2++2e﹣=Cu,所以若電路中有0.04摩爾電子通過時,陰極增重
2Cu+O2↑+2H2SO4;0.4mol;(3)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,陽極應該是粗銅、陰極是純銅,則X電極是純銅、Y電極是粗銅,陰極上銅離子放電,電極反應式為Cu2++2e﹣=Cu,所以若電路中有0.04摩爾電子通過時,陰極增重 ![]() ×64=1.28g,所以答案是:①純銅;②Cu2++2e﹣=Cu;③1.28.
×64=1.28g,所以答案是:①純銅;②Cu2++2e﹣=Cu;③1.28.


 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:
【題目】將物質的量均為3.00mol物質A,B混合于5L容器中,發生如下反應:3A+B2C,在反應過程中C的物質的量分數隨溫度變化如圖所示: 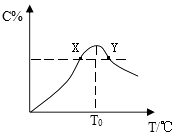
(1)T0對應的反應速率v(正)v(逆)(用“=”、“>”或“<”表示,下同);
(2)此反應的正反應為熱;(填“放”或“吸”)
(3)X,Y兩點A物質正反應速率的大小關系是YX;
(4)溫度T<T0時,C%逐漸增大的原因是:;
(5)若Y點的C的物質的量分數為25%,則參加反應的A物質的量為mol.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組欲制取氨氣并探究其性質.請回答:
(1)實驗室利用固體與固體反應制取氨氣的化學方程式是 .
(2)①上圖是進行氨氣噴泉實驗的裝置,引發噴泉的操作步驟是 . ②氨氣使燒杯中溶液由無色變為紅色,其原因是(用方程式表示) .
(3)在上圖的燒瓶中充滿干燥氣體,膠頭滴管及燒杯中分別盛有液體.下列組合中不可能形成噴泉的是
A.HCl和H2O
B.NH3和H2O
C.NH3和苯
D.CO2和燒堿溶液.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A.碳酸氫鈣溶液與鹽酸反應:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
B.石灰石溶于鹽酸中:CaCO3+2H+=Ca2++CO2↑+H2O
C.硫酸銅溶液與氫氧化鋇溶液混合:Cu2++2OH﹣=Cu(OH)2↓
D.氧化鐵與稀硫酸反應:Fe2O3+6H+=Fe2++3H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫恒容下,將2mol氣體A和2mol氣體B通入體積為2L的密閉容器中,發生如下反應:2A(g)+B(g)![]() xC(g)+2D(s),2min后反應達到平衡狀態,此時剩余1.2mol B,并測得C的濃度為1.2mol/L。
xC(g)+2D(s),2min后反應達到平衡狀態,此時剩余1.2mol B,并測得C的濃度為1.2mol/L。
(1)從開始反應到平衡狀態,生成C的平均反應速率為__________。
(2)x=_________,該反應的化學平衡表達式為________________。
(3)A的轉化率與B的轉化率之比為________。
(4)下列各項可作為該反應達到平衡狀態的標志是_______(填字母)。
A.壓強不再變化 B.氣體密度不再變化
C.氣體平均相對分子質量不再變化 D.A的消耗速率與B的消耗速率之比為2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在化學反應中如果反應前后元素化合價發生改變,就一定有轉移,這類反應就屬于反應.如果元素化合價升高,表明該元素原子電子,含該元素的物質發生反應,這種物質是劑;元素化合價降低,表明該元素的原子電子,含該元素的物質發生反應,這種物質是劑.在中學化學中常用作氧化劑的物質(任寫一種)常用作還原劑的物質有(任寫一種).硫在氧氣中燃燒的化學方程式;其中,硫是劑.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】當溶液中X2O72-和SO32-的離子數之比為1:3時正好完全發生氧化還原反應,X在還原產物中的化合價為
A. +1 B. +2 C. +3 D. +4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學研究性學習小組欲設計實驗驗證Fe、Cu的金屬活動性,他們提出了以下兩種方案.請你幫助他們完成有關實驗項目:
方案Ⅰ:有人提出將大小相等的鐵片和銅片,分別同時放入稀硫酸或稀鹽酸中,觀察產生氣泡的快慢,據此確定它們的活動性.該原理的離子方程式為 .
方案Ⅱ:有人利用Fe、Cu作電極設計成原電池,以確定它們的活動性.試在下面的方框內畫出原電池裝置圖,標出原電池的電極材料和電解質溶液,
并寫出電極反應式.正極反應式:;負極反應式:;
方案Ⅲ:結合你所學的知識,幫助他們再設計一個驗證Fe、Cu活動性的簡單實驗方案與方案Ⅰ、Ⅱ不能雷同: , 用離子方程式表示其反應原理: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,試回答下列問題 (燈泡功率合適):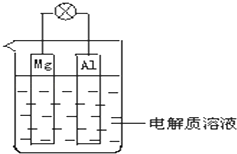
(1)該裝置是(填“原電池”或“電解池”.)
(2)電解質溶液為稀H2SO4時,Mg電極為極,Al電極為極填“正”或“負”),電子由電極流出,電解質溶液中SO ![]() 向(填“左”或“右”)移動,Mg電極上發生的反應為:Al電極上發生的反應為:
向(填“左”或“右”)移動,Mg電極上發生的反應為:Al電極上發生的反應為:
(3)電解質溶液為NaOH(aq)時,則Mg電極為極,Al電極為:極(填“正”或“負”),電子由電極流出,電解質溶液中(填離子符號)向右移動,Mg電極上發生的反應為: , Al電極上發生的反應為: .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com