
【題目】某黃酮類藥物的合成涉及反應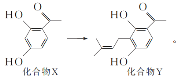 下列說法正確的是( )
下列說法正確的是( )
A.化合物X在空氣中能穩定存在
B.化合物X中所有碳原子可處于同一平面
C.化合物X、Y都可與溴水發生加成反應
D.1mol化合物Y最多可以與4molH2反應
 優生樂園系列答案
優生樂園系列答案 新編小學單元自測題系列答案
新編小學單元自測題系列答案科目:高中化學 來源: 題型:
【題目】科學家曾合成具有獨特結構的化合物1和2,發現化合物1加熱后可得化合物2。以下關于化合物1和2的說法中正確的是( )
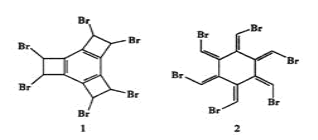
A. 化合物1和2互為同分異構體
B. 化合物1中所有原子處于同一平面
C. 化合物1和2均屬于芳香族化合物
D. 1 mol化合物2完全燃燒消耗O213.5 mol (Br燃燒生成![]() HBr)
HBr)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知一個碳原子連兩個—OH的結構不穩定,會很快脫去一分子水,其變化如下:
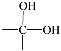 →
→ ![]() + H2O
+ H2O
下圖中B和![]() 、
、![]() 等都是A和Cl2發生反應生成的產物,E是一種高分子化合物,透光性能好,常用作一些燈飾外殼。過程中一些小分子都已經略去。
等都是A和Cl2發生反應生成的產物,E是一種高分子化合物,透光性能好,常用作一些燈飾外殼。過程中一些小分子都已經略去。
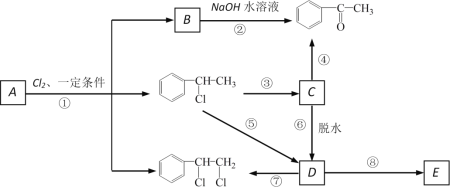
(1)A的化學名稱為_____________
(2)第⑦步的化學方程式為___________________________,該反應類型為_____;
(3)E的結構簡式為______;
(4)符合下列條件:苯環上有兩個取代基且苯環上只有兩種不同化學環境的氫的C的同分異構體的結構簡式分別是_______________、_____________、________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中物質的量濃度為1mol·L-1的是( )
A. 將20g NaOH固體溶解在500mL水中
B. 將10g NaOH固體溶解在水中配成250mL溶液
C. 將1L 10 mol·L-1的濃鹽酸與9L水混合
D. 將標準狀況下22.4L HCl氣體溶于1L水中配成溶液(已知HCl極易溶于水,0℃時,1體積水能溶解500體積的氯化氫)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】100mL 0.3mol/L Na2SO4溶液和50mL0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42-的物質的量濃度約為(不考慮混合后溶液體積的變化)
A.0.20mol/LB.0.25mol/LC.0.40mol/LD.0.50mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室需要0.1mol·L-1NaOH溶液450mL和0.5mol·L-1硫酸溶液500mL。根據這兩種溶液的配制情況回答下列問題:
(1)如圖所示的儀器中配制溶液肯定不需要的是__________(填序號),配制上述溶液還需用到的玻璃儀器是__________(填儀器名稱)。
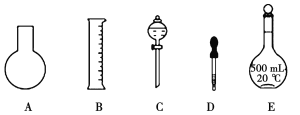
(2)配制0.1mol·L-1NaOH溶液操作步驟如下:
①把稱量好的NaOH`固體放入小燒杯中,加適量蒸餾水溶解;
②把①所得溶液冷卻至室溫,再小心轉入一定容積的容量瓶中;
③繼續向容量瓶中加蒸餾水至液面距刻度線1~2cm處,改用膠頭滴管小心滴加蒸餾水至溶液凹液面與刻度線相切;
④用少量蒸餾水洗滌燒杯和玻璃棒2~3次,每次洗滌的液體都小心轉入容量瓶,并輕輕搖勻;
⑤將容量瓶瓶塞塞緊,充分搖勻。
操作步驟的正確順序為__________(填序號)。
(3)根據計算用托盤天平稱取NaOH的質量為__________g。在實驗中其他操作均正確,若容量瓶用蒸餾水洗滌后未干燥,則所得溶液濃度______________0.10mol·L-1(填“大于”“等于”或“小于”,下同)。若還未等溶液冷卻就定容了,則所得溶液濃度__________0.10mol·L-1。
(4)根據計算得知,所需質量分數為98%、密度為1.84g·cm-3的濃硫酸的體積為__________mL(計算結果保留一位小數)。如果實驗室有10mL、15mL、20mL、50mL的量筒,應選用__________mL的量筒最好。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把13g Zn放入足量的鹽酸中,Zn完全反應。計算:
(1)13g Zn的物質的量___________
(2)參加反應的HCl的物質的量___________
(3)生成H2的體積(標準狀況)___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列選項中離子能大量共存的是( )
(1)與鋁粉反應放出H2的無色溶液:NO3-、Al3+、Na+、SO42-
(2)含有大量NO3-的溶液:H+、Fe2+、Cl-、SO42-
(3)中性溶液:Fe3+、Al3+、NO3-、SO42-
(4)使pH試紙顯藍色的溶液:Cu2+、NO3-、Fe3+、SO42-
(5)含有大量Fe3+的溶液:Na+、SCN-、Cl-、I-
(6)常溫下![]() =1×10-12的溶液:K+、AlO2-、CO32-、Na+
=1×10-12的溶液:K+、AlO2-、CO32-、Na+
(7)c(H+)=0.1 mol·L-1的溶液:Na+、NH4+、SO42-、S2O32-
A.(3)(6)B.(2)(3)(6)C.(6)D.(2)(6)(7)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學課外活動小組擬用鉛蓄電池進行電絮凝凈水的實驗探究,設計的實驗裝置示意圖如下。下列敘述正確的是
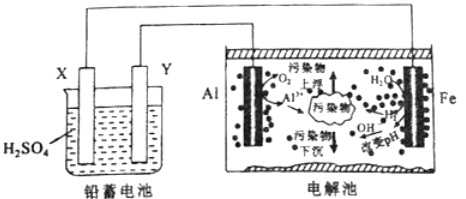
A.Y的電極反應為:Pb-2e-+SO42-=PbSO4
B.電解池內僅發生反應:2Al+6H2O=2Al(OH)3↓+3H2↑
C.若電解池陰極上有0.5mol H2生成,則鉛蓄電池中消耗H2SO4為98g
D.用電絮凝法凈化過的水,pH顯著升高
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com