
【題目】近年來,研究人員提出利用含硫物質熱化學循環實現太陽能的轉化與存儲。過程如下:
(1)反應Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反應Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反應Ⅱ的熱化學方程式:________________________________。
(2)I-可以作為水溶液中SO2歧化反應的催化劑,可能的催化過程如下。將ii補充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+_________=_________+_______+2 I-_____________
(3)探究i、ii反應速率與SO2歧化反應速率的關系,實驗如下:分別將18 mL SO2飽和溶液加入到2 mL下列試劑中,密閉放置觀察現象。(已知:I2易溶解在KI溶液中)
序號 | A | B | C | D |
試劑組成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
實驗現象 | 溶液變黃,一段時間后出現渾濁 | 溶液變黃,出現渾濁較A快 | 無明顯現象 | 溶液由棕褐色很快褪色,變成黃色,出現渾濁較A快 |
①B是A的對比實驗,則a=__________。
②比較A、B、C,可得出的結論是______________________。
③實驗表明,SO2的歧化反應速率D>A,結合i、ii反應速率解釋原因:________________。
【答案】3SO2(g)+2H2O (g)=2H2SO4(l)+S(s)ΔH2=254kJ·mol1 SO2、SO42、4H+ 0.4 I是SO2歧化反應的催化劑,H+單獨存在時不具有催化作用,但H+可以加快歧化反應速率 反應ii比i快,D中由反應ii產生的H+使反應i加快
【解析】
(1)根據蓋斯定律:反應Ⅱ=反應Ⅰ-反應Ⅲ:ΔH=-551kJ·mol-1+297kJ·mol-1=-254 kJ·mol-1,因此,反應Ⅱ的熱化學方程式為:3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH2=254kJ·mol1;綜上所述,本題答案是:3SO2(g)+2H2O (g)=2H2SO4(l)+S(s)ΔH2=254kJ·mol1 。
(2)SO2的水溶液發生歧化反應為:3SO2+2H2O=4H++2SO42-+ S↓,所以反應ii=(總反應-反應i)×1/2:I2+2H2O+ SO2= SO42+4H++2 I-;綜上所述,本題答案是:SO2、SO42、4H+。
(3)①B是A的對比實驗,采用控制變量法,B比A多加了0.2 mol·L-1H2SO4,B與A中 KI濃度應相等,則a=0.4,綜上所述,本題答案是:0.4。
②對比A與B,加入H+可以加快SO2歧化反應的速率;對比B與C,單獨H+不能催化SO2的歧化反應;比較A、B、C,可得出的結論是: I是SO2歧化反應的催化劑, H+單獨存在時不具有催化作用,但 H+可以加快歧化反應速率;綜上所述,本題答案是:I是SO2歧化反應的催化劑,H+單獨存在時不具有催化作用,但H+可以加快歧化反應速率。
③對比D和A,D中加入碘化鉀的濃度小于A,D中多加了碘單質,反應ⅰ消耗H+和I,反應ⅱ中消耗I2,D中“溶液由棕褐色很快褪色,變成黃色,出現渾濁較A快”,反應速率D>A,由此可見,反應ⅱ比反應ⅰ速率快,反應ⅱ產生H+使c(H+)增大,從而反應ⅰ加快;綜上所述,本題答案是:反應ii比i快,D中由反應ii產生的H+使反應i加快。


科目:高中化學 來源: 題型:
【題目】已知:(1)實驗室制取Cl2的方程式為:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,其中MnO2發生了__反應,是__劑;每4分子氯化氫中只有___分子發生了___反應,鹽酸是___劑。
MnCl2+Cl2↑+2H2O,其中MnO2發生了__反應,是__劑;每4分子氯化氫中只有___分子發生了___反應,鹽酸是___劑。
(2)室溫下KMnO4與濃鹽酸反應制取氯氣的化學方程式:2KMnO4+16HCl(濃)===2KCl+2MnCl2+8H2O+5Cl2↑,請在上式中用單線橋法表示出不同元素的原子間得失電子的情況。___
(3)用CuCl2作催化劑,在450℃時用空氣中的O2跟HCl反應也能制得氯氣,其化學方程式:4HCl+O2![]() 2H2O+2Cl2,從氯元素化合價的變化看,以上三種制氯氣方法的共同點是__;比較以上三個反應,可以認為氧化劑的氧化能力從強到弱的順序為___。
2H2O+2Cl2,從氯元素化合價的變化看,以上三種制氯氣方法的共同點是__;比較以上三個反應,可以認為氧化劑的氧化能力從強到弱的順序為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬(Ti)是航空、宇航、軍工、電子等方面的必需原料。在生產鈦的過程中可用鎂在加熱條件下與TiCl4反應制得金屬鈦,反應的化學方程式為:TiCl4+2Mg![]() Ti+2MgCl2。該反應屬于( )
Ti+2MgCl2。該反應屬于( )
A. 化合反應B. 分解反應C. 置換反應D. 無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】印刷銅制電路板的腐蝕液選取和回收再利用一直是研究的熱點。
(1)FeCl3溶液一直作為傳統的腐蝕液。
① 腐蝕過程中的離子方程式為______。
![]()
② 腐蝕結束后,通過以下兩步可分離出銅,并實現FeCl3溶液再生。
i. 步驟I所加試劑和操作分別為______。
ii. 可實現步驟II轉化的物質或方法是______(填一種即可)。
(2)研究發現,CuCl2溶液添加鹽酸或氨水配制成酸性腐蝕液或堿性腐蝕液,其效果優于FeCl3溶液。腐蝕液的主要成分及腐蝕原理如下:
腐蝕液類型 | 主要成分 | 腐蝕原理 |
酸性腐蝕液 | Cu2+、H+、Cl- | Cu+ Cu2++2Cl- CuCl+2Cl- |
堿性腐蝕液 | Cu(NH3)42+、NH4+、NH3、Cl- | Cu(NH3)42++ Cu === 2Cu(NH3)2+ |

①酸性腐蝕液中銅離子含量對腐蝕速率的影響如右圖所示,為保持較快和較平穩的腐蝕速率,腐蝕液中銅離子含量應選擇______ g/100mL的使用范圍。
②酸性腐蝕廢液經過處理后,倒入一定量的水中,可得CuCl沉淀,過濾、洗滌、干燥后即得產品CuCl。倒入一定量的水中,可得CuCl沉淀的原因是_______。
③ 通入適量的氧氣可使堿性腐蝕液再生。將該過程的離子方程式補充完整:______________
![]()
(3)H2O2也常用來腐蝕金屬銅,使用時加入鹽酸或氨水將其配制成酸性或堿性腐蝕液。回收其廢液的工藝如下:


① 酸性條件下H2O2腐蝕金屬銅的離子方程式為______。
② 右圖是研究堿性腐蝕液的溫度對銅腐蝕量的實驗結果,升高溫度,腐蝕量變化的原因______。
③ 堿轉時的反應為:Cu2(OH)3Cl+NaOH =CuO+Cu(OH)2+NaCl+H2O。檢驗轉化完全的方法是:取少量洗滌后的堿轉固體,_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】完成下列問題 某小組利用H2C2O4溶液和酸性KMnO4溶液反應來探究“外界條件對化學反應速率的影響”。實驗時,先分別量取兩種溶液,然后倒入試管中迅速振蕩混合均勻,開始計時,通過測定褪色所需時間來判斷反應的快慢。該小組設計了如下方案:
實驗編號 | H2C2O4溶液 | 酸性KMnO4溶液 | 溫度 | ||
濃度(mol·L-1) | 體積(mL) | 濃度(mol·L-1) | 體積 (mL) | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)為了觀察到紫色褪去,H2C2O4與KMnO4初始的物質的量需要滿足的關系為n(H2C2O4)∶n(KMnO4)≥ ______。
(2)探究溫度對化學反應速率影響的實驗編號是________(填編號,下同),可探究反應物濃度對化學反應速率影響的實驗編號是________。
(3)實驗①測得KMnO4溶液的褪色時間為40s,忽略混合前后溶液體積的微小變化,這段時間內平均反應速率v(KMnO4)=________mol·L-1·min-1。
(4)已知實驗③中c(MnO4—)~反應時間t的變化曲線如下圖。若保其他條件不變,請在圖中畫出實驗②中c(MnO4—)~t的變化曲線示意圖。_______

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯甲酸是常用的防腐劑和重要的醫藥原料。一種藥用苯甲酸的制備方法如下:
Ⅰ.在反應罐中加入甲苯、飽和KMnO4溶液、Fe2O3(催化劑),加熱、回流數小時,充分反應。
Ⅱ.反應結束后,改為蒸餾裝置。加熱蒸餾,直至冷凝管壁不再出現油珠。
Ⅲ.將反應罐中的混合物趁熱過濾,濾渣用少量熱水洗滌。
Ⅳ.向濾液中滴加濃鹽酸酸化至pH=2,抽濾,用少量水洗滌,干燥得苯甲酸粗品。
Ⅴ.將粗苯甲酸加入……,結晶、洗滌、過濾,得到藥用純苯甲酸。
已知:相關物質的溶解度(g/mL)
溫度(℃) | 25 | 50 | 60 | |
苯甲酸 | 在水中 | 0.0034 | 0.0085 | 0.0095 |
在乙醇中 | 0.4 | 0.7 | 1 | |
氯化鉀 | 在乙醇中 | 難溶 | ||
(1)Ⅰ中發生的主要反應為:![]() (未配平),則Ⅳ中發生反應的離子方程式為______。
(未配平),則Ⅳ中發生反應的離子方程式為______。
(2)Ⅱ中蒸餾的目的是______。
(3)Ⅲ中趁熱過濾的目的是______。
(4)將Ⅴ中操作補充完整:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】FeSe 、MgB2等超導材料具有廣闊的應用前景。
(1)基態Fe原子價層電子的電子排布圖(軌道表達式)為________,基態Se原子的電子占據最高能級的電子云輪廓圖為________形。
(2)向FeSe中嵌入吡啶(![]() )能得到具有優異性能的超導材料。吡啶中氮原子的雜化類型為________;該分子內存在________(填標號)。
)能得到具有優異性能的超導材料。吡啶中氮原子的雜化類型為________;該分子內存在________(填標號)。
A.σ鍵 B.π鍵 C.配位鍵 D.氫鍵
(3)將金屬鋰直接溶于液氨,得到具有很高反應活性的金屬電子溶液,再通過系列反應可制得FeSe基超導材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空間構型為________。
②液氨是氨氣液化的產物,氨氣易液化的原因是________。
③金屬鋰溶于液氨時發生反應:Li + (m+n)NH3=X+e-(NH3)n。X的化學式為________。
(4)MgB2晶體結構如圖所示。B原子獨立為一層,具有類似于石墨的結構,每個B原子周圍都有________個與之等距離且最近的B原子;六棱柱底邊邊長為a cm,高為c cm,阿伏加德羅常數的值為NA ,該晶體的密度為________ g·cm-3(列出計算式)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向20mL0.lmol·L-1NH4HSO4溶液中滴入0.1mol·L-1NaOH溶液,溶液中由水電離出的c水(H+)與所加NaOH溶液的體積的關系如圖所示。下列分析正確的是
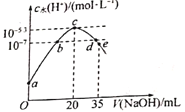
A. b點時,溶液的pH=7
B. 常溫下,Kb(NH3·H2O)=1.0×10-5.3
C. Vd<30 mI
D. e點溶液中粒子濃度由大到小的順序為c(Na+)>c(SO42-)>c(NH4+)>c(NH3·H2O )>c(OH- )>c(H+)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com