
| U | |||
| W | Y |
分析 U、W、Y是原子序數依次增大的短周期主族元素,W是地殼中含量最多的金屬元素,W是Al元素;根據元素在周期表中的位置可知U為C元素、Y為S元素.
(1)元素U為碳,原子核外電子排布式為1s22s22p2;
(2)升高溫度、增大反應物接觸面積,可以加快反應速率,對有氣體參加的反應,增大壓強可以提高反應速率,本題中適當增大氫離子濃度可以加快反應速率,但Al在濃硫酸中會發生鈍化現象;
(3)①正反應放熱反應,升高溫度平衡逆向移動,平衡常數減小;
②可逆反應到達平衡時,同種物質的正、逆反應速率相等(不同種物質的正、逆速率之比等于其化學計量數之比),各組分的含量保持不變,物理量隨反應進行由變化到不變,說明到達平衡;
③利用三段式計算平衡時各組分物質的量、各組分變化量,再根據v=$\frac{△c}{△t}$計算ν(O2),根據K=$\frac{{c}^{2}(Y{O}_{3})}{{c}^{2}(Y{O}_{2})×v({O}_{2})}$計算平衡常數.
等效為開始加入0.40molYO2和0.20molO2,結合平衡常數計算.
解答 解:U、W、Y是原子序數依次增大的短周期主族元素,W是地殼中含量最多的金屬元素,W是Al元素;根據元素在周期表中的位置可知U為C元素、Y為S元素.
(1)元素U為碳,原子核外電子排布式為1s22s22p2,其原子核外共有1s、2s、2p三種能級電子,
故答案為:3;
(2)a.Al在濃硫酸中會發生鈍化現象,使用濃硫酸不能加快反應速率,故a錯誤;
b.升高溫度,可以加快反應速率,故b正確;
c.沒有氣體參加反應,加壓不能加快反應速率,故c錯誤;
d.使用等質量的W粉末,增大接觸面積,可以加快反應速率,故d正確,
故選:bd;
(3)①正反應放熱反應,升高溫度平衡逆向移動,平衡常數減小,即450℃時的平衡常數大于500℃時的平衡常數,
故答案為:>;
②a.2ν(O2)正=ν(YO3)逆時,說明YO3正、逆反應速率相等,反應達到平衡狀態,故a正確;
b.反應為氣體物質的量減小的反應,而氣體質量不變,隨反應進行平均分子量增大,容器中氣體的平均分子量不隨時間而變化說明反應達到平衡狀態,故b正確;
c.氣體總質量不變,恒容密閉容器中氣體的密度始終不變,故c錯誤;
d.反應為氣體物質的量減小的反應,容器中氣體的分子總數不隨時間而變化說明反應達到平衡狀態,故d正確,
故選:abd;
③半分鐘后達到平衡,測得容器中含YO30.18mol,則:
2YO2(g)+O2(g)?2YO3(g)
起始(mol):0.2 0.1 0
變化(mol):0.18 0.09 0.18
平衡(mol):0.02 0.01 0.18
故ν(O2)=$\frac{\frac{0.09mol}{2L}}{0.5min}$=0.09mol/(L.min),
平衡常數K=$\frac{{c}^{2}(Y{O}_{3})}{{c}^{2}(Y{O}_{2})×v({O}_{2})}$=$\frac{(\frac{0.18}{2})^{2}}{(\frac{0.02}{2})^{2}×\frac{0.01}{2}}$=16200,
等效為開始加入0.40molYO2和0.20molO2,設平衡時YO3物質的量為x,則:
2YO2(g)+O2(g)?2YO3(g)
起始(mol):0.4 0.2 0
變化(mol):x 0.5x x
平衡(mol):0.4-x 0.2-0.5x x
所以$\frac{(\frac{x}{2})^{2}}{(\frac{0.4-x}{2})^{2}×\frac{0.2-0.5x}{2}}$=16200,
解得x≈0.368
故答案為:0.09mol/(L.min);16200;0.368mol.
點評 本題以元素推斷為載體,考查核外電子排布、化學反應速率影響因素、平衡常數、化學平衡狀態判斷、化學平衡有關計算等,(3)中計算量大,為易錯點,平衡狀態判斷中變化量不再變化時說明到達平衡.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| 反應時間/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反應在t1min內的平均速率為v(H2)=$\frac{0.4}{{t}_{1}}$mol.L-1.min-1 | |
| B. | 溫度升至800℃,上述反應平衡常數為0.64,則正反應為吸熱反應 | |
| C. | 保持其他條件不變,若向平衡體系中再通入0.20mol H2O,與原平衡相比,達到新平衡時CO和H2O的轉化率均增大 | |
| D. | 保持其他條件不變,若起始時向容器中充入0.60mol CO和1.20 mol H2O,則到達平衡時,n(CO2)=0.40 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
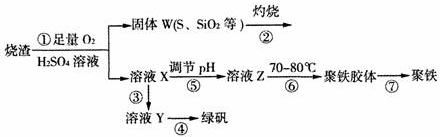
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
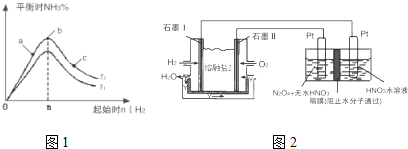
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 溫度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
| K/(×10-8 mol3•L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
| A. | 若Z的體積分數不再隨時間變化時表示反應達平衡狀態 | |
| B. | 35 oC時,達平衡時,X分解了 0.03 mol | |
| C. | 該反應在高溫下可能自發 | |
| D. | 若在恒溫下,壓縮容器體積,再次達平衡后,n(X)比原平衡大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
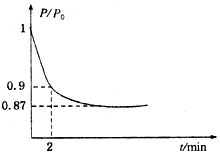 能源的開發利用與人類社會的可持續性發展息息相關.
能源的開發利用與人類社會的可持續性發展息息相關.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蒸餾實驗時,在燒瓶內加幾粒沸石以防止暴沸 | |
| B. | 制蒸餾水時,應使溫度計水銀球雄近蒸館燒瓶的支管口處 | |
| C. | 分液操作時,分液漏斗中下層液體從下口放出,上層液體從上口倒出 | |
| D. | 進行過濾時,玻璃棒的末端應輕輕靠在三層的濾紙上 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com