
【題目】下列說法正確的是
A.凡有能量變化的過程都是化學變化
B.吸熱反應只能在加熱條件下才能進行
C.放熱反應可能需要加熱才能進行
D.天然氣燃燒時,其化學能將全部轉化為熱能
 探究與鞏固河南科學技術出版社系列答案
探究與鞏固河南科學技術出版社系列答案科目:高中化學 來源: 題型:
【題目】在密閉容器中,一定條件下進行如下反應:NO (g) +CO(g)![]()
![]() N2(g) +CO2 (g) △H=-373.2 kJ/mol達到平衡后,為提高該反應的速率和NO的轉化率,采取的正確措施是( )
N2(g) +CO2 (g) △H=-373.2 kJ/mol達到平衡后,為提高該反應的速率和NO的轉化率,采取的正確措施是( )
A. 加催化劑同時升高溫度 B. 加催化劑同時增大壓強
C. 升高溫度同時充入N2 D. 降低溫度同時增大壓強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色) ![]() 2CrO42-(黃色)+2H+ 。用K2Cr2O7溶液進行下列實驗,結合實驗,下列說法不正確的是( )
2CrO42-(黃色)+2H+ 。用K2Cr2O7溶液進行下列實驗,結合實驗,下列說法不正確的是( )
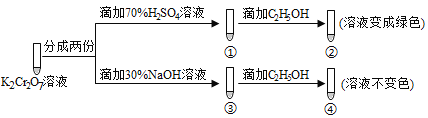
A. ①中溶液橙色加深,③中溶液變黃 B. ②中Cr2O72-被C2H5OH還原
C. 若向④中加入70%H2SO4溶液至過量,溶液變為橙色 D. 對比②和④可知K2Cr2O7酸性溶液氧化性強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸氯(C1NO)是有機合成中的重要試劑。可由NO與Cl2在通常條件下反應得到,化學方程式為2NO(g)+C12(g)![]() 2C1NO(g),
2C1NO(g),
(1)氮氧化物與懸浮在大氣中的海鹽粒子相互作用時會生成亞硝酸氯,涉及如下反應:
① 2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
② 4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③ 2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
則K1,K2,K3之間的關系為K3=______________。
(2)已知幾種化學鍵的鍵能數據如下表(亞硝酸氯的結構為Cl-N=O):

則2NO(g)+C12(g)![]() 2C1NO(g)反應的△H和a的關系為△H=________kJ/mol。
2C1NO(g)反應的△H和a的關系為△H=________kJ/mol。
(3)在1L的恒容密閉容器中充入2molNO(g)和1molC12(g),在不同溫度下測得c(C1NO)與時間的關系如圖A:
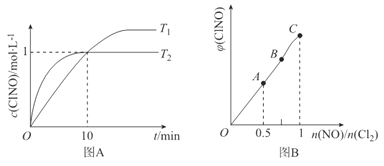
① 由圖A可判斷T1 ________T2,該反應的△H________0 (填“>”“<”或“=”)。
② 反應開始到10min時NO的平均反應速率v(NO)=____________mol/(L·min)。
③ T2時該反應的平衡常數K=____________。
(4) 一定條件下在恒溫恒容的密閉容器中按一定比例充入NO(g)和Cl2(g),平衡時ClNO的體積分數隨n(NO)/n(C12)的變化圖象如圖B,則A、B、C三狀態中,NO的轉化率最大的是________點。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列冶煉方法中,可制得相應金屬單質的是 ( )
A. 電解熔融AlCl3制鋁 B. 加熱分解Ag2O制銀
C. 電解飽和食鹽水制鈉 D. 高溫下分解CaCO3制鈣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中發生如下反應:mA(g)+nB(g) ![]() pC(g),達到平衡后,保持溫度不變,將氣體體積縮小到原來的
pC(g),達到平衡后,保持溫度不變,將氣體體積縮小到原來的![]() ,當達到新平衡時,C的濃度為原來的1.5倍,下列說法正確的是( )
,當達到新平衡時,C的濃度為原來的1.5倍,下列說法正確的是( )
A. ![]() B. 平衡向逆反應方向移動
B. 平衡向逆反應方向移動
C. A的轉化率不變 D. C的體積分數增加
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用含銅、鐵的粗鋅制備硫酸鋅及相關物質。工藝流程圖及有關數據如下:

物質 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-38 | 1.2×10-23 | 8.5×10-45 |
請回答下列問題:
(1)粗鋅中的銅與混酸的稀溶液反應的化學方程式為__________________________,圖中處理氣體X要能夠體現綠色化學思想,還需補充氣體______(填化學式)。
(2)若溶液I中c(Cu2+)為0.05mol·L-1,則溶液II中c(Fe3+)>____mol·L-1。
(3)若固體A是Zn,取9.61 g固體C溶解于足量的500mL 2 mol·L-1稀硝酸中,共收集到標準狀況下2.24L的氣體,向所得溶液中加入2 mol·L-1NaOH溶液,則當生成沉淀最多時,沉淀的質量為_____g;若固體A是另一種物質,取部分固體C于試管中,加入鹽酸產生有臭雞蛋味氣體,則該反應的離子方程式為________________________。
(4)溶液Ⅲ經過蒸發濃縮、____________、過濾、洗滌、干燥,即得到較純凈的硫酸鋅晶體;溶液還可以制備ZnS,實際選擇的是(NH4)2S溶液而不是Na2S溶液作為反應物,理由是后者制得的ZnS含有較多的雜質,則該雜質是____________(填化學式)。
(5)金屬鋅常用作酸性干電池的負極,干電池不使用時,由于負極與電解質溶液接觸而發生自放電反應:2NH4++Zn=2NH3+H2↑+Zn2+,造成電量自動減少。寫出鉛蓄電池不使用時,其正極上發生自放電的化學方程式__________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com