
 HCl+HClO。加入少量下列物質能使c(HClO)增大
HCl+HClO。加入少量下列物質能使c(HClO)增大| A.CaCO3 | B.NaOH | C.CaSO4 | D.HCl |
科目:高中化學 來源:不詳 題型:單選題
 C的反應中,若增大壓強或降低溫度,B的轉化率均增大,則反應體系應是( )
C的反應中,若增大壓強或降低溫度,B的轉化率均增大,則反應體系應是( ) | A.A是固體、C是氣體,正反應吸熱 | B.A是氣體、C是液體,正反應放熱 |
| C.A是氣體、C是氣體,正反應放熱 | D.A是氣體、C是氣體,正反應吸熱 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
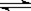 CO2(g)+H2(g)的平衡常數隨溫度的變化如下表:
CO2(g)+H2(g)的平衡常數隨溫度的變化如下表:| 溫度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常數K | 10 | 9 | 1 | 0.6 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| 物質 | X | Y | Z |
| 初始濃度/mol·L—1 | 0.1 | 0.2 | 0 |
| 平衡濃度/mol·L—1 | 0.05 | 0.05 | 0.1 |
 2 Z,其平衡常數為1600
2 Z,其平衡常數為1600查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2NO2(g) ΔH=+52.70 kJ·mol—1。在恒溫、恒容的密閉容器中進行上述反應,達到平衡時,描述中不正確的是
2NO2(g) ΔH=+52.70 kJ·mol—1。在恒溫、恒容的密閉容器中進行上述反應,達到平衡時,描述中不正確的是| A.若再向容器內繼續通入少量N2O4,則平衡向正反應方向移動 |
| B.新平衡時,NO2的體積分數小于原平衡時NO2的體積分數 |
| C.新平衡時,容器中氣體的平均相對分子質量比原平衡大 |
| D.新平衡時,混合氣體顏色變淺,容器中氣體的密度增大 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.Fe(SCN)3溶液中加入固體KSCN后顏色變深 |
| B.棕紅色NO2加壓后顏色先變深后變淺 |
| C.SO2催化氧化成SO3的反應,往往使用過量的空氣 |
| D.H2、I2、HI平衡混和氣加壓后顏色變深 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2C(g)達到平衡的標志的是( )
2C(g)達到平衡的標志的是( )查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 C(g)+D(g)反應的平衡常數和溫度的關系如下:
C(g)+D(g)反應的平衡常數和溫度的關系如下:| |溫度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常數 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)的平衡常數的值為 。
A(g)+B(g)的平衡常數的值為 。查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com