
【題目】為有效控制霧霾,各地積極采取措施改善大氣質量,研究并有效控制空氣中的氮氧化物、碳氧化物含量顯得尤為重要.
(1)汽車內燃機工作時會引起N2和O2的反應:N2+O2═2NO,是導致汽車尾氣中含有NO的原因之一;在T1、T2溫度下,一定量的NO發生分解反應時N2的體積分數隨時間變化如圖1所示,根據圖象判斷反應N2(g)+O2(g)═2NO(g)的△H0(填“>”或“<”). 
(2)NOx是汽車尾氣中的主要污染物之一.汽車發動機工作時會引起N2和O2反應,其能量變化如圖2所示,寫出該反應的熱化學方程式 .
【答案】
(1)>
(2)N2(g)+O2(g)=2NO(g)△H=+183 kJ?mol﹣1
【解析】解:(1)根據圖象判斷,T2曲線先到達平衡,反應速率大,溫度較高,而溫度升高,氮氣的體積分數減小,說明升高溫度平衡向正反應移動,升高溫度向吸熱方向進行,故正反應為吸熱反應,△H>0.
所以答案是:>;(2)該反應中的反應熱=反應物的鍵能和﹣生成物的鍵能和=(945+498)kJ/mol﹣2×630kJ/mol=+183kJ/mol,熱化學方程式為:N2(g)+O2(g)=2NO(g)△H=+183 kJmol﹣1 ,
所以答案是:N2(g)+O2(g)=2NO(g)△H=+183 kJmol﹣1 .
【考點精析】認真審題,首先需要了解反應熱和焓變(在化學反應中放出或吸收的熱量,通常叫反應熱).


科目:高中化學 來源: 題型:
【題目】往2L密閉容器中充入NO2,在三種不同條件下發生反應2NO2(g) ![]() 2NO(g)+O2(g),實驗測得NO2的濃度隨時間的變化如下表(不考慮生成N2O4)
2NO(g)+O2(g),實驗測得NO2的濃度隨時間的變化如下表(不考慮生成N2O4)
濃度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
實驗1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
實驗2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
實驗3/850℃ | 1.00 | 0.50 | 0.40 | 0.15 | 0.15 | 0.15 |
下列說法正確的是
A. 實驗2使用了比實驗1效率更高的催化劑
B. 實驗2的反應容器體積比實驗1的小
C. 通過實驗2和實驗3可判斷該反應是放熱反應
D. 實驗2的平衡常數比實驗3的大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷的電子式為 , 碳氫鍵之間鍵角為 . 甲烷和氯氣在光照下發生取代反應,生成種產物.產物中常用作滅火劑.試寫出三溴甲烷在光照條件下與溴蒸氣反應的化學方程式:
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應:2NO2![]() 2NO+O2在恒容容器中進行,達到平衡狀態的標志是
2NO+O2在恒容容器中進行,達到平衡狀態的標志是
①單位時間內生成n molO2,的同時生成2n molNO2
②單位時間內生成n molO2的同時生成2n molNO
③用NO2、NO、O2的物質的量濃度變化表示的反應速率之比為2:2:1的狀態
④混合氣體的顏色不再改變的狀態
⑤混合氣體的密度不再改變的狀態
⑥混合氣體的平均相對分子質量不再改變的狀態
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等雜質),實驗室利用毒重石制備BaCl2·2H2O的流程如下:
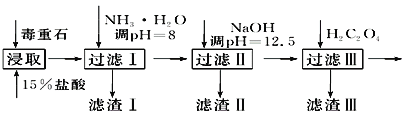
(1)毒重石用鹽酸浸取前需充分研磨,目的是_______________________________________;實驗室用37%的鹽酸配制15%的鹽酸,除量筒外還需使用下列儀器中的________。
a.燒杯 b.一定容積的容量瓶 c.玻璃棒 d.滴定管
(2)查閱有關資料獲得沉淀各種雜質離子的pH見下表:
沉淀雜質離子 | Ca2+ | Mg2+ | Fe3+ |
開始沉淀時的pH | 11.9 | 9.1 | 1.9 |
完全沉淀時的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O調節pH=8可除去______(填離子符號);濾渣Ⅱ中含__________(填化學式)。加入H2C2O4時應避免過量,原因是_____________________(已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9)。
(3)利用間接酸堿滴定法可測定Ba2+的含量,實驗分兩步進行。已知:2CrO![]() +2H+===Cr2O
+2H+===Cr2O![]() +H2O Ba2++CrO
+H2O Ba2++CrO![]() ===BaCrO4↓
===BaCrO4↓
步驟Ⅰ.準確移取x mL一定濃度的Na2CrO4溶液于錐形瓶中,加入幾滴酸堿指示劑,用b mol·L-1鹽酸標準液滴定至終點,測得滴加鹽酸體積為V0 mL。
步驟Ⅱ.準確移取y mL BaCl2溶液于錐形瓶中,加入x mL與步驟Ⅰ 相同濃度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸堿指示劑,用b mol·L-1鹽酸標準液滴定至終點,測得滴加鹽酸的體積為V1mL。
滴加鹽酸標準液時應用酸式滴定管,“0”刻度位于滴定管的________(選填“上方”或“下方”)。BaCl2溶液的濃度為________________mol·L-1,若步驟Ⅱ中滴加鹽酸時有少量待測液濺出,則所測得Ba2+濃度測量值將________(選填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】廢舊鋰離子電池的回收利用的意義重大,其正極廢料的主要成分是LiCoO2、鋁、炭黑及其他雜質,回收利用的流程如下:

已知“溶液A”中主要金屬離子是Co2+、Li+,還含有少量Fe3+、Al3+、Cu2+。
(1)步驟①中鋁溶解的離子方程式為_________________,固體X的成分是_________。
(2)步驟②中LiCoO2固體溶解的化學方程式為_______________ ,該反應的還原劑是_______。
(3)母液中含量最大的三種離子是_________。
(4) (NH4)2C2O4是一種化學實驗室常用的試劑,預測其溶解性___________(填“可溶于水”或“不溶于水”)。一定溫度下,(NH4)2C2O4固體可分解出NH3和CO等物質,思考其它的產物并寫出其分解的化學方程式__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一密閉容器中充入1mol H2(g)和1mol I2(g),壓強為P(Pa),并在一定溫度下使其反應:H2(g)+I2(g)![]() 2HI(g) △H<0.
2HI(g) △H<0.
(1)保持容器的容積不變,向其中加入1mol H2,反應速率_____(填“加快”“減慢”“無影響”), 理由是_______________________________________________________________.
(2)保持容器的容積不變,向其中加入1molN2(不參與反應),反應速率______.(填“加快”“減慢”“無影響”) 理由是________________________________________________.
(3)保持容器內氣體的壓強不變,向其中加入1mol N2(不參與反應),反應速率____.(填“加快”“減慢”“無影響”) 理由是_____________________________________________.
(4)保持容器內氣體的壓強不變,向其中加入1mol H2和1mol I2(g),反應速率______.(填“加快”“減慢”“無影響”) 理由是____________________________________________.
(5)提高起始的反應溫度,反應速率______.(填“加快”“減慢”“無影響”) 理由是_________________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸工業產生的廢氣A(主要成分:SO2、O2、N2、CO2等)排放到空氣中會污染環境。某化學興趣小組對廢氣A的組成進行探究,請回答下列問題。
(1)同學甲設計實驗檢驗廢氣A中含有CO2,應選擇的試劑有_________。
A.NaOH溶液 B.酸性KMnO4溶液 C.澄清石灰水 D.鹽酸
(2)同學乙欲測定廢氣A中SO2的含量,取a L廢氣A并設計了如下裝置進行實驗。

①為了保證實驗成功,裝置A應具有的現象是___________,攪拌的目的是___________。
②同學丙認為A裝置前后的質量差就是a L廢氣中含有的SO2的質量,然后進行含量計算。經小組討論后,同學丁提出疑問,按照同學丙的實驗,若廢氣中SO2完全被吸收,則最后測定的結果應該偏大,同學丁推斷的理由是_______________________________。
(3)興趣小組的同學查閱資料發現可利用硫酸工業廢氣A制備皓礬(ZnSO4·7H2O)。實驗模擬制備皓礬工業流程如下:

①氧化中加入硫酸鐵發生反應的離子方程式是____________________。
②加入Zn粉的目的是_________________________________。
③固體A主要成分是__________________。
④操作b得到純凈皓礬晶體,必要的操作是蒸發濃縮、__________、過濾、洗滌、干燥。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com