
分析 (1)設達到平衡時,Pb2+的濃度減小x mol•L-1,利用三段表示出平衡濃度,帶入Ks計算;
(2)根據Qc與Ks的大小判斷反應進行的方向;
(3)根據平衡表達式計算出Pb2+的平衡濃度,反應開始時[Pb2+]等于其平衡濃度加上0.1mol•L-1.
解答 解:(1)設達到平衡時,Pb2+的濃度減小x mol•L-1,則,
Pb2++Sn?Pb+Sn2+
初始濃度 0.1 0
轉化濃度 x x
平衡濃度 0.1-x x
Ks=$\frac{x}{0.1-x}$=2.41,解得x=0.07,
因此達到平衡時,Pb2+和Sn2+的濃度各是(0.1-0.07)mol•L-1=0.03mol•L-1、0.07mol•L-1,
答:若初始濃度[Pb2+]=0.1mol•L-1,達到平衡時,Pb2+和Sn2+的濃度各是0.03mol•L-1、0.07mol•L-1.
(2)若[Pb2+]=0.1mol•L-1,[Sn2+]=0.1mol•L-1,Qc=$\frac{0.1}{0.1}$=1<2.41,反應向著正反應方向移動,
答:若[Pb2+]=0.1mol•L-1,[Sn2+]=0.1mol•L-1,反應將向正反應方向進行.
(3)Pb2+的平衡濃度[Pb2+]=$\frac{[S{n}^{2+}]}{K{\;}_{s}}$=$\frac{0.1}{2.41}$mol•L-1=0.04mol•L-1,反應開始時[Pb2+]為0.04mol•L-1+0.1mol•L-1=0.14mol•L-1,
答:若平衡時,[Sn2+]=0.1mol•L-1,反應開始時[Pb2+]是0.14mol•L-1.
點評 本題考查了化學平衡常數的應用,難度中等,會書寫平衡常數表達式并能通過據Qc與Ks的大小判斷反應進行的方向是解題的關鍵,三段法是化學平衡常數計算中常用的方法.


科目:高中化學 來源: 題型:解答題
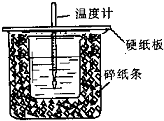 已知中和熱的定義為:稀溶液中酸和堿發生中和反應生成1mol水的反應熱,某化學興趣小組要完成中和熱的測定實驗,裝置如右圖,回答下列問題:
已知中和熱的定義為:稀溶液中酸和堿發生中和反應生成1mol水的反應熱,某化學興趣小組要完成中和熱的測定實驗,裝置如右圖,回答下列問題:| 實 驗 用 品 | 溶液溫度(℃) | 中和熱△H(kJ•mol-1) | |||
| t1 | t2 | ||||
| ① | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.3 | -56.8 |
| ② | 50 mL 0.50 mol•L-1NaOH | 50 mL 0.50 mol•L-1HCl | 20 | 23.5 | |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
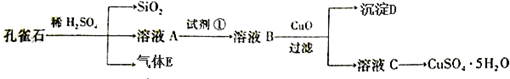
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | 乙醛 | 乙酸 | 甘油[X& | 乙二醇 | 水 |
| 沸點 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
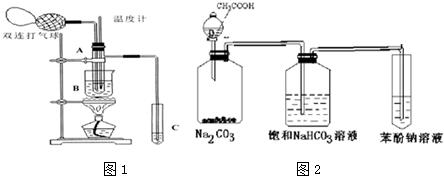
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河南省高二上第一次月考化學卷(解析版) 題型:選擇題
在恒溫恒容 密閉容器中,能說明反應:2N02(g)
密閉容器中,能說明反應:2N02(g) 2NO(g)+02(g)達到平衡
2NO(g)+02(g)達到平衡 狀態的是 ( )
狀態的是 ( )
①單位時間內生成nmol O2的同時生成2nmol NO2;②單位時間內生成nmol O2的同時生成2nmol N0;③混合氣體的顏色不再改變;④混合氣體的密度不再改變的狀態;⑤混合氣體的平均相對分子質量不再改變的狀態。
A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | H-H | O=O |
| 鍵能/kJ/mol | 436 | 498 |
| A. | 463.4kJ/mol | B. | 926.8kJ/mol | C. | 221.6kJ/mol | D. | 413kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含1.2NA個離子的固體Na2O2溶于水配成1L溶液,所得溶液中Na+的物質的量濃度為0.6mol•L-1 | |
| B. | Na在空氣中長期放置變成Na2CO3粉末 | |
| C. | 過量的澄清石灰水分別與Na2CO3溶液和NaHCO3溶液反應,現象不同 | |
| D. | 滴加KSCN顯紅色的溶液中可大量存在NH4+、K+、Cl-、I- |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 常溫常壓下,16g O2和32g O3的混合物中,含有O原子數月為3NA | |
| B. | 標準狀況下,1mol Na2O和1mol Na2O2的混合物中,含有離子總數為7NA | |
| C. | 1 mol NaBH4中離子鍵的數目為2NA | |
| D. | 在K${\;}_{\;}^{35}$ClO3+6H${\;}_{\;}^{37}$Cl═KCl+3Cl2↑+3H2O中,若生成71 g Cl2,轉移的電子數目為$\frac{5}{3}$NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com