
【題目】亞硝酰氯(ClNO)是有機合成中的重要試劑,可由NO與Cl2在通常條件下反應得到,化學方程式為2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物與懸浮在大氣中的海鹽粒子相互作用時會生成亞硝酰氯,涉及如下反應:① 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)
NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)![]() 2ClNO(g) K3,則K1、K2、K3之間的關系為K3=_______________(用K1和K2表示);
2ClNO(g) K3,則K1、K2、K3之間的關系為K3=_______________(用K1和K2表示);
(2)已知幾種化學鍵的鍵能數據如下表:(亞硝酰氯的結構為Cl—N==O)
化學鍵 | N≡O | Cl-Cl | Cl-N | N==O |
鍵能/(kJ·mol-1) | 630 | 243 | a | 607 |
則2NO(g)+Cl2(g)![]() 2ClNO(g)的反應的 △H和a的關系為 △H = ___kJ·mol-1。
2ClNO(g)的反應的 △H和a的關系為 △H = ___kJ·mol-1。
(3)300℃時,2NO(g)+Cl2 (g)![]() 2ClNO(g)的正反應速率表達式為v正 = k·cn (ClNO),測得速率和濃度的關系如下表:
2ClNO(g)的正反應速率表達式為v正 = k·cn (ClNO),測得速率和濃度的關系如下表:
序號 | c(ClNO)/(mol·L-1) | v/(mol·L-1·s-l) |
① | 0. 30 | 3. 60×10-9 |
② | 0. 60 | 1. 44×10-8 |
③ | 0. 90 | 3. 24×10-8 |
n = ___;k = ____。
(4)若向絕熱恒容密閉容器中充入物質的量之比為2 : 1的NO和Cl2進行反應2NO(g)+Cl2(g)![]() 2ClNO(g),能判斷反應已達到化學平衡狀態的是__(填標號)。
2ClNO(g),能判斷反應已達到化學平衡狀態的是__(填標號)。
a.容器中的壓強不變 b.2v正(NO) = v逆(Cl2)c.氣體的平均相對分子質量保持不變 d.該反應平衡常數保持不變e.NO和Cl2的體積比保持不變
(5)25℃時,向體積為2 L且帶氣壓計的恒容密閉容器中通入0.08 mol NO和0.04 mol Cl2發生反應:2NO(g)+Cl2 (g)![]() 2ClNO(g)△H。
2ClNO(g)△H。
①若反應起始和平衡時溫度相同,測得反應過程中壓強(p)隨時間(t)的變化如圖甲曲線a所示,則 △H __(填“>”“<”或“不確定”)0;若其他條件相同,僅改變某一條件時,測得其壓強(p)隨時間(t)的變化如圖甲曲線b所示,則改變的條件是______。

②圖是甲、乙同學描繪上述反應平衡常數的對數值(lg K)與溫度的變化關系,其中正確的曲線是____(填“甲”或“乙”),m值為_____。

【答案】K3=![]() 289-2a 2 4. 0×10-8 L·mol-1·s-1 acd < 加入催化劑 乙 2
289-2a 2 4. 0×10-8 L·mol-1·s-1 acd < 加入催化劑 乙 2
【解析】
(1)利用方程式疊加關系得到平衡常數之間的關系;
(2)利用鍵能計算焓變,反應物的鍵能之和減去生成物的鍵能之和就是焓變;
(3)將表中數據帶入速率方程即可求得n和k;
(4)平衡狀態的判定;
(5)列三段式計算平衡常數,進而去計算。
(1)①![]() ②
②![]() 將①×2②可得:
將①×2②可得:![]() ,則平衡常數
,則平衡常數![]() ,
,
故答案為:![]() ;
;
(2)![]() 反應的△H=反應物的鍵能之和生成物的鍵能之和
反應的△H=反應物的鍵能之和生成物的鍵能之和![]() ,
,
故答案為:289-2a;
(3)根據表格①②中的數據,帶入速率公式然后做比值:![]() ,解得n=2,將n代入①中得k=4×108,
,解得n=2,將n代入①中得k=4×108,
故答案為:2;4. 0×10-8 L·mol-1·s-1;
(4)a.對于反應![]() ,反應前后氣體系數變化,故壓強是變量,故當壓強不再變化說明反應已經平衡,a正確;
,反應前后氣體系數變化,故壓強是變量,故當壓強不再變化說明反應已經平衡,a正確;
b. 2v正(NO) = v逆(Cl2),正逆反應速率不相等,反應未達到平衡狀態,b錯誤;
c. 氣體的平均相對分子質量即平均摩爾質量等于總質量比總物質的量,總質量雖然不變,但是總物質的量會改變,故平均相對分子質量是變量,當它不再變化則說明反應已經達到平衡狀態,c正確;
d. 絕熱容器中,溫度會改變,溫度改變平衡常數就會改變,當平衡常數不再變化則說明反應已經達到平衡狀態,d正確;
e.![]() 和
和![]() 的體積比始終是2:1,不是變量,故不能說明達到平衡狀態,e錯誤;
的體積比始終是2:1,不是變量,故不能說明達到平衡狀態,e錯誤;
答案選acd;
(5)①由圖甲分析可知,隨反應的進行壓強先增大后減小,5min達到平衡狀態,推知開始因反應是放熱的,隨反應進行溫度升高,壓強增大;反應到一定程度,因反應物濃度減小,隨反應正向進行,壓強反而減小,到壓強隨時間變化不變時,達到平衡狀態,反應焓變為△H<0;由圖甲知:化學反應速率加快,平衡不動,故改變的條件:加入催化劑;
答案為:<;加入催化劑;
②T升高,平衡左移,K減小,lgK減小,曲線選乙,設反應的氯氣物質的量為x,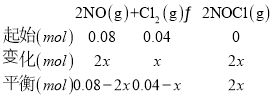 根據壓強之比等于物質的量之比,得到:
根據壓強之比等于物質的量之比,得到:![]() ,解得:x=0.02mol,依據計算得到平衡時物質的濃度代入x求得:
,解得:x=0.02mol,依據計算得到平衡時物質的濃度代入x求得:![]() ;
;![]() ;
;![]() ;
;
平衡常數: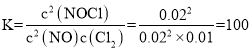 ,lgK=lg100=2,m=2;
,lgK=lg100=2,m=2;
故答案為:乙;2。


 智能訓練練測考系列答案
智能訓練練測考系列答案科目:高中化學 來源: 題型:
【題目】將一定量的X加入某密閉容器中,發生反應:2X(g)![]() 3Y(g)+Z(g),混合氣體中X的物質的量分數與溫度關系如圖所示:下列推斷不正確的是( )
3Y(g)+Z(g),混合氣體中X的物質的量分數與溫度關系如圖所示:下列推斷不正確的是( )

A.升高溫度,該反應平衡常數K增大
B.壓強大小有P3>P2>P1
C.反應過程中加入高效催化劑可以縮短達到平衡的時間
D.在該條件下M點X平衡轉化率為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過碳酸鈉是一種多用途的新型漂白劑,化學式可表示為aNa2CO3·bH2O2,過碳酸鈉溶于水分解成Na2CO3和H2O2。
(1)FeOCl常用作過碳酸鈉使用時的催化劑。FeCl3·6H2O在250℃時分解可得到FeOCl,該反應的化學方程式為______________________________________。
(2)測定某樣品中過碳酸鈉化學式的實驗步驟如下(樣品中雜質不參加反應):
步驟Ⅰ:稱取樣品0.800 0 g于錐形瓶中,加水溶解,滴加甲基橙作指示劑,用0.200 0 mol·L-1H2SO4溶液滴定至終點,消耗硫酸25.00 mL。
步驟Ⅱ:另稱取樣品0.800 0 g于錐形瓶中,加水溶解,加稀硫酸酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至終點(滴定過程中MnO被還原為Mn2+),消耗KMnO4溶液30.00 mL。
①步驟Ⅰ中,滴定終點的現象是____________________。
②步驟Ⅱ中,若樣品溶于水酸化后放置一段時間,然后再進行滴定,則過碳酸鈉化學式中a∶b的測定結果將________(填“偏大”“偏小”或“無影響”)。
③通過計算確定該過碳酸鈉化學式(寫出計算過程)。___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】PET(![]() ,M鏈節= 192 g·mol1)可用來生產合成纖維或塑料。測某PET樣品的端基中羧基的物質的量,計算其平均聚合度:以酚酞作指示劑,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至終點(現象與水溶液相同),消耗NaOH醇溶液v mL。下列說法不正確的是
,M鏈節= 192 g·mol1)可用來生產合成纖維或塑料。測某PET樣品的端基中羧基的物質的量,計算其平均聚合度:以酚酞作指示劑,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至終點(現象與水溶液相同),消耗NaOH醇溶液v mL。下列說法不正確的是
A.PET塑料是一種可降解高分子材料
B.滴定終點時,溶液變為淺紅色
C.合成PET的一種單體是乙醇的同系物
D.PET的平均聚合度![]() (忽略端基的摩爾質量)
(忽略端基的摩爾質量)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列對分子性質的解釋中,不正確的是( )
A.碘易溶于四氯化碳,甲烷難溶于水都可用相似相溶原理解釋
B.由于乳酸(![]() )中存在一個手性碳原子,導致該物質存在互為鏡像的兩個手性異構體;生產中可利用“手性合成”法主要得到其中一種手性分子
)中存在一個手性碳原子,導致該物質存在互為鏡像的兩個手性異構體;生產中可利用“手性合成”法主要得到其中一種手性分子
C.![]() 的穩定性很強,是因為其分子間能形成氫鍵
的穩定性很強,是因為其分子間能形成氫鍵
D.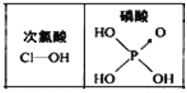 由圖可知酸性:
由圖可知酸性:![]() ,是因為
,是因為![]() 分子中有1個非羥基氧原子
分子中有1個非羥基氧原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化鉻綠(Cr2O3)的性質獨特,在冶金、顏料等領域有著不可替代的地位。一種利用淀粉水熱還原鉻酸鈉(Na2CrO4)制備氧化鉻綠的工藝流程如下:
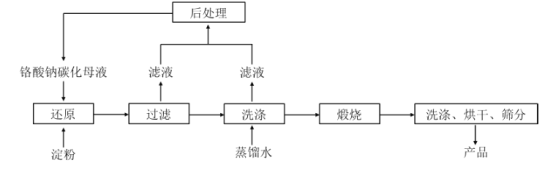
已知:①向含少量 Na2 CO3的鉻酸鈉堿性溶液中通入CO 2可制得不同碳化率的鉻酸鈉碳化母液;
②“還原”反應劇烈放熱,可制得 Cr(OH) 3 漿料。
(1)鉻酸鈉(Na2CrO4)中鉻元素的價態是________,該工藝中“還原”反應最初使用的是蔗糖或甲醛,請寫出甲醛的電子式:________________,后來改用價格低廉的淀粉。請寫出甲醛(HCHO)與鉻酸鈉(Na2CrO4)溶液反應的離子方程式___________________________ 。
(2)將混合均勻的料液加入反應釜,密閉攪拌,恒溫發生“還原”反應,下列有關說法錯誤的是____________(填標號)。
A.該反應一定無需加熱即可進行 B.必要時可使用冷卻水進行溫度控制
C.鉻酸鈉可適當過量,使淀粉充分反應 D.應建造廢水回收池,回收含鉻廢水
(3)測得反應完成后在不同恒溫溫度、不同碳化率下 Cr(Ⅵ)還原率如下圖。實際生產過程中 Cr(Ⅵ)還原率可高達 99.5%以上,“還原”階段采用的最佳反應條件為________________。
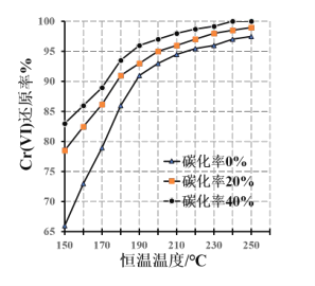
(4)濾液中所含溶質為_________________。該水熱法制備氧化鉻綠工藝的優點有________________ 、___(請寫出兩條)。
(5)重鉻酸鈉(Na2Cr2O7·H2O)與硫酸銨熱分解法也是一種生產氧化鉻綠的方法,生產過程中產生的氣體對環境無害,其化學反應方程式為______________________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列解釋事實的方程式不正確的是( )
A.用K3[Fe(CN)6]檢驗Fe2+的離子反應方程式:2Fe(CN)63- + 3Fe2+= Fe3[Fe(CN)6]2 ↓
B.含氟牙膏防治齲齒的原理是氟離子會跟羥基磷灰石發生沉淀轉化生成氟磷灰石的離子反應方程式:Ca5(PO4)3(OH) +F- ![]() Ca5(PO4)3F +OH -
Ca5(PO4)3F +OH -
C.用TiCl4制備TiO2的化學方程式:TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
D.已知在重鉻酸鉀溶液中存在著如下平衡:Cr2O72-+ H2O![]() H++ 2CrO42-
H++ 2CrO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用 0.1 mol·L-1 KOH 溶液滴定 10 mL 0.1 mol·L-1 HA(Ka =1.0×10-5)溶液的滴定曲線如圖所示。下列說法正確的是( )
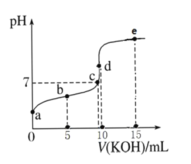
A.a 點溶液的 pH 約為 5
B.水的電離程度:c 點>d 點
C.b 點溶液中粒子濃度大小: c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
D.e 點溶液中:c(K+)=2c(A-)+2c(HA)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向等物質的量濃度的K2S、KOH混合溶液中滴加稀鹽酸至過量。其中主要含硫各物種(H2S、HS、S2)的分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與滴加鹽酸體積的關系如圖所示(忽略滴加過程H2S氣體的逸出)。下列說法不正確的是
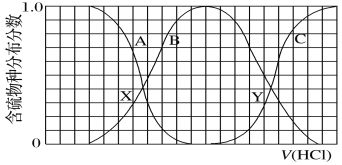
A.A曲線表示S2-隨鹽酸加入量增加時的分布分數改變情況
B.X、Y為曲線兩交叉點。若已知Y點處的pH,則可計算Ka1(H2S)
C.X、Y點對應溶液中水的電離程度大小關系為:X<Y
D.Y點對應溶液中c(K+)與含硫各微粒濃度的大小關系為:c(K+)=3[c(H2S)+c(HS)+c(S2)]
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com