
【題目】化學反應中的能量變化是由化學反應中舊化學健斷裂時吸收的能量與化學健形成時放出的能量不同引起的。如圖為N2(g)和O2(g)反應生成NO(g)過程中的能量變化,下列說法中正確的是
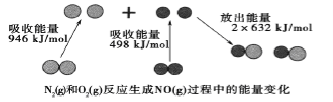
A.1molN2(g)和1molO2(g)反應放出的能量為180kJ
B.1molN2(g)和1molO2(g)具有的總能量小于2molNO(g)具有的總能量
C.在1L的容器中發生反應.10min內N2減少了1mol,因此10min內的平均反應速率為v(NO)=0.1mol/(L·min)
D.NO是一種酸性氧化物,能與NaOH溶液反應生成鹽和水
【答案】B
【解析】
試題分析:A.反應熱就是斷鍵吸收的能量和形成化學鍵所放出的能量的差值,所以該反應的反應熱是946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,所以該反應是吸熱反應,A項錯誤,B.根據上述分析,該反應為吸熱反應,1molN2(g)和1molO2(g)具有的總能量小于2molNO(g)具有的總能量,B項正確;C.10min內N2減少了1mol,則NO增加了2moL,因此10min內的平均反應速率為v(NO) = 2mol ÷ (1L × 10min)=0.2mol/(L·min),C項錯誤;D.NO與NaOH不反應,不是酸性氧化物,D項錯誤;答案選B。


 字詞句段篇系列答案
字詞句段篇系列答案科目:高中化學 來源: 題型:
【題目】鐵炭混合物(鐵屑和活性炭的混合物)、納米鐵粉均可用于處理水中污染物。
(1)鐵炭混合物在水溶液中可形成許多微電池。將含有Cr2O72-的酸性廢水通過鐵炭混合物,在微電池正極上Cr2O72-轉化為Cr3+,其電極反應式為_____________。
(2)在相同條件下,測量總質量相同、鐵的質量分數不同的鐵炭混合物對水中Cu2+和Pb2+的去除率,結果如圖所示。

①當鐵炭混合物中鐵的質量分數為0時,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②當鐵炭混合物中鐵的質量分數大于50%時,隨著鐵的質量分數的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)納米鐵粉可用于處理地下水中的污染物。
①一定條件下,向FeSO4溶液中滴加堿性NaBH4溶液,溶液中BH4-(B元素的化合價為+3)與Fe2+反應生成納米鐵粉、H2和B(OH)4-,其離子方程式為_________。
②納米鐵粉與水中NO3-反應的離子方程式為4Fe+NO3-+10H+=4Fe2++NH4++3H2O.研究發現,若pH偏低將會導致NO3-的去除率下降,其原因是__________。
③相同條件下,納米鐵粉去除不同水樣中NO3-的速率有較大差異(如下圖),產生該差異的可能原因是____________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種熔融碳酸鹽燃料電池原理示意如圖。下列有關該電池的說法正確的是
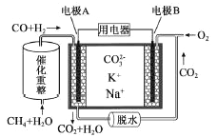
A. CH4+H2O![]() 3H2+CO,每消耗1mol CH4轉移12mol電子
3H2+CO,每消耗1mol CH4轉移12mol電子
B. 電極A上H2參與的電極反應為:H2+2OH--2e-=2H2O
C. 電極B上發生的電極反應為:O2+2CO2+4e-=2CO32-
D. 電池工作時,CO32-向電極B移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)![]() 2NO2(g) △H,隨溫度升高,混合氣體的顏色變深。回答下列問題:
2NO2(g) △H,隨溫度升高,混合氣體的顏色變深。回答下列問題:
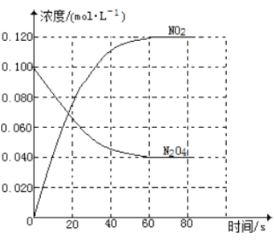
(1)反應的△H 0(填“>”或“<”);100℃時,體系中各物質濃度隨時間變化如圖所示。在0~60s時段,反應速率v(NO2)為 mol·L-1·s-1,反應的平衡常數K為 。
(2)100℃時達平衡后,改變反應溫度為T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,經10s又達到平衡。則T 100℃(填“大于”或“小于”)。
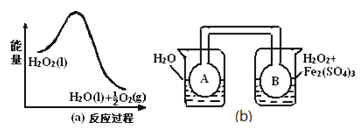
(3)利用圖(a)和(b)中的信息,按圖(b)裝置(連通的A、B瓶中已充有NO2氣體)進行實驗。可觀察到B瓶中氣體顏色比A瓶中的 (填“深”或“淺”),其原因是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學用Na2CO3配制0.10mol.L-1Na2CO3溶液的過程如圖所示,你認為該同學的錯誤有

A. ②③ B. ④⑤ C. ①⑥ D. ①⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計如下實驗方案,以分離KCl和BaCl2兩種固體混合物,試回答下列問題。

(1)B物質的化學式為。
(2)在蒸發操作中必須用到蒸發皿,下面對蒸發皿的操作中正確的是
A.將蒸發皿放置在鐵架臺的鐵圈上直接用酒精燈火焰加熱
B.將蒸發皿放置在鐵架臺的鐵圈上,并加墊石棉網加熱
C.將蒸發皿放置在三腳架上直接用酒精燈火焰加熱
D.在三腳架上放置泥三角,將蒸發皿放置在泥三角上加熱
(3)該方案的明顯失誤是因為某一步設計不當而使分離產物不純,該步正確的方案可以設計為。
(4)若要測定原混合物中KCl和BaCl2的質量分數,除了要準確稱量混合物的質量外,至少還要獲得的數據是的質量。
(5)請按要求寫出下列離子方程式:
生成沉淀A:_____________________________________________________
沉淀A與鹽酸反應:______________________________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com