
【題目】某校的化學興趣小組利用下列實驗裝置探究二氧化硫的性質,E中裝有常見氣體,與E裝置相連的玻璃導管可根據需要變換長短。
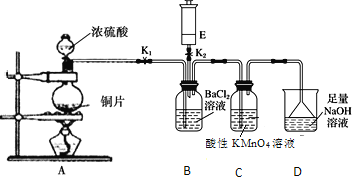
實驗開始時關閉K2打開K1,從分液漏斗中向燒瓶內加入濃硫酸。
(1)A中發生反應的化學方程式是:________________________________________。
(2)C中的現象是______________,證明SO2有____________性。
(3)D的作用是_____________________,反應的離子方程式為____________。
(4)A中反應完成后,關閉K1,打開K2,將E中的無色氣體緩緩注入B中,有白色沉淀產生:
①若E是無色有刺激性氣味氣體,它的分子式為________ (填化學式)
②若E是無色無味氣體, 產生的白色沉淀是_________(填化學式)。
(5)若將B中溶液換成Ba(NO3)2溶液,將會有白色沉淀生成,請用離子方程式解釋其原因________________。
【答案】Cu+2H2SO4(濃)![]() CuSO4+SO2↑+2H2O 紫色褪去 還原 吸收多余SO2,防止污染空氣 SO2+2OH-=SO32-+H2O NH3 BaSO4 3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+
CuSO4+SO2↑+2H2O 紫色褪去 還原 吸收多余SO2,防止污染空氣 SO2+2OH-=SO32-+H2O NH3 BaSO4 3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+
【解析】
在裝置A中Cu與濃硫酸混合加熱反應產生SO2氣體,將SO2通入B裝置的BaCl2溶液中二者不能發生反應,將SO2通入酸性KMnO4溶液,二者發生氧化還原反應,溶液的紫色褪去,SO2是大氣污染物,可根據其是酸性氧化物能夠與堿反應的性質用NaOH溶液進行尾氣處理,然后排放。將裝置E中氣體通入B中,會產生白色沉淀,若E是無色有刺激性氣味的氣體,則該氣體是NH3,NH3與SO2及H2O反應產生(NH4)2SO3,(NH4)2SO3與BaCl2產生BaSO3白色沉淀;若E是無色無味的氣體,則該氣體是O2或O3,能夠與溶解在溶液中SO2及H2O反應產生H2SO4,H2SO4與BaCl2產生BaSO4白色沉淀,SO2、H+、NO3-會發生氧化還原反應產生SO42-,據此分析解答。
(1)A中Cu與濃硫酸混合加熱發生反應產生CuSO4、SO2、H2O,發生反應的化學方程式是Cu+2H2SO4(濃)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)酸性KMnO4溶液具有強的氧化性,SO2具有還原性,二者在溶液中發生氧化還原反應,使酸性KMnO4溶液的紫色褪去,因此看到C中的現象是紫色變為無色,證明SO2具有還原性;
(3)D中NaOH用于吸收多余的SO2氣體,防止大氣污染,即D的作用是吸收多余SO2,防止污染空氣,該反應的離子方程式為:SO2+2OH-=SO32-+H2O;
(4)①SO2是酸性氣體,能夠與堿發生中和反應產生亞硫酸鹽,若E是無色有刺激性氣味氣體,則該氣體是NH3,與SO2在溶液中反應產生(NH4)2SO3,(NH4)2SO3與BaCl2產生BaSO3白色沉淀;
②SO2具有強的還原性,若E是無色無味氣體,則該氣體是O2或O3,O2或O3具有強的氧化性,可以與溶解在溶液中SO2及H2O反應產生H2SO4,H2SO4與BaCl2產生BaSO4白色沉淀;
(5)SO2溶于水反應產生H2SO3,使溶液顯酸性,在酸性條件下NO3-具有強的氧化性,可以將SO2、H2SO3氧化為H2SO4,產生SO42-與Ba2+結合形成BaSO4白色沉淀,用離子方程式表示為:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+。


 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案科目:高中化學 來源: 題型:
【題目】合成氣的主要組分為CO和H2;以天然氣為原料生產的合成氣有多種方法,其中Sparg工藝的原理為CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定溫度下,向甲、乙、丙三個密閉容器中充入相同量的CH4(g)和CO2(g),改變容器體積,測得平衡時容器內氣體的濃度如下表所示:
實驗編號 | 容器溫度/℃ | 容器體積 | 物質濃度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列說法正確的是( )
A.該反應在低溫條件下不能自發進行
B.300 ℃時反應的平衡常數為25
C.V1∶V2=3∶7
D.保持溫度和容器體積不變,開始時向甲容器中充入0.28 mol CO和0.28 mol H2,CO轉化率一定大于2/7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴 A 是有機化學工業的基本原料,其產量可以用來衡量一個國家的石油化工發展水平, A可發生如圖所示的一系列化學反應,其中①②③屬于同種反應類型。根據圖回答下列問題:

(1)物質D有特殊香味,生活中常用于飲料、燃料、消毒,D的名稱為________,含有的官能團為________。
(2)寫出②、④兩步反應的化學方程式,并注明反應類型:
②______________________,反應類型__________。
④______________________,反應類型_________。
(3)圖中由A制備C的最好途徑是通過反應_______(填寫“②”或“①⑤”):理由是:_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏伽德羅常數,下列說法正確的是
A. 1molCS2分子中含有1NA個π鍵
B. 31g白磷(P4)分子中所含的共價鍵數目為1NA
C. 電解精煉銅時,若陽極質量減少64g,則陰極轉移的電子數目一定為2NA
D. 在1mol[Cu(H2O)4]2+中含有12NA個![]() 鍵
鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】MnSO4晶體是一種易溶于水的微紅色晶體,某校同學設計實驗制備并檢驗MnSO4的性質。回答下列問題:
(1)甲組同學設計用SO2和適量純凈的MnO2制備MnSO4,其裝置如下:
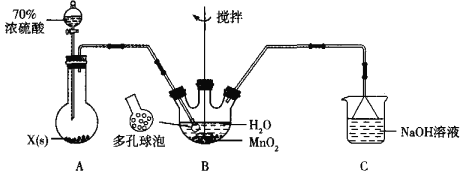
①A裝置中固體藥品X通常是______填化學式)。
②B裝置中通SO2的導管末端接多孔球泡的目的是______;C裝置用于吸收少量的SO2,發生反應的離子方程式為______。
(2)乙組同學定性檢驗甲組同學的產品中Mn2+的存在,取少量晶體溶于水,加入(NH4)2S2O8溶液,滴入硝酸銀(作催化劑),微熱振蕩,溶液顯紫色,發生反應的離子方程式為______。
(3)丙組同學為檢驗無水MnSO4(接近白色)的熱分解產物,將MnSO4晶體脫水后放入下圖所示的裝置中,打開K1和K2,緩慢通入N2,加熱,硬質玻璃管中最后得到黑色固體。
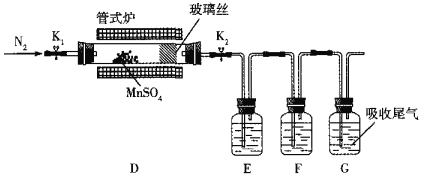
①檢驗分解的氣態產物中是否有SO2及SO3,裝置E、F中的溶液依次是______、______(填字母)。
a.Ba(NO3)2溶液b.BaCl2溶液c.品紅溶液d.濃硫酸
②若D中得到的黑色粉末為Mn3O4,E、F中均有明顯現象,則D中發生反應的化學方程式為______。
(4)丁組同學設計實驗以丙組同學得到的黑色粉末為原料,利用鋁熱反應原理將其還原為金屬錳,所需的藥品除氯酸鉀外,還需要______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來AIST報告正在研制一種“高容量、低成本”的鋰-銅空氣燃料電池,該電池通過一種復雜的銅腐蝕“現象”產生電力,其中放電過程為:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列說法正確的是
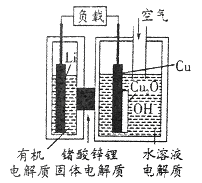
A. 正極為Li,負極為Cu
B. 放電時,正極的電極反應為:2Cu+2OH-+2e-==Cu2O+2H2O
C. Li極有機電解質可以換成Cu極的水溶液電解質
D. 通空氣時,整個反應過程中,銅相當于催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按圖1所示裝置進行實驗,若圖2中x軸表示流入正極的電子的物質的量,則y軸可以表示

①c(Ag+) ②c(NO3-) ③a棒的質量 ④b棒的質量 ⑤溶液的質量
A.僅①③B.僅①③⑤C.僅②④D.僅②④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關性質的比較,不能用元素周期律解釋的是
A.酸性:![]()
B.熱穩定性:Na2 CO3![]() NaHCO3
NaHCO3
C.與水反應的速率:Na![]() Mg
Mg
D.非金屬性:Cl![]() Br
Br
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式的書寫及評價均合理的是( )
選項 | 離子方程式 | 評價 |
A | 將2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正確;Cl2過量,可將Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液與足量的NaOH溶液反應: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正確;酸式鹽與堿反應生成正鹽和水 |
C | 過量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正確;說明酸性:H2SO3強于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等體積混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正確;第一步反應和第二步反應消耗的H+的物質的量之比為2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com