
【題目】2 L密閉容器中進行反應:pZ(g)+qQ(g) ![]() mX(g)+nY(g),式中m、n、p、q為化學計量數。在0~3 min內,各物質的物質的量的變化如下表所示:
mX(g)+nY(g),式中m、n、p、q為化學計量數。在0~3 min內,各物質的物質的量的變化如下表所示:
物質 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol | 0.8 |
已知:2 min內v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
請回答下列問題:
(1)2 min內X的反應速率v(X)=__________。
(2)起始時n(Y)=__________。
(3) 3 min末是否達到平衡_______(填是或否)。
(4)對于該反應,能增大正反應速率的措施是________(填序號,下同)。
A.縮小容器體積 B.移走部分Q
C.通入大量He氣 D.升高溫度
【答案】0.025 mol·L-1·min-1 2.3 mol 是 A D
【解析】
根據圖表數據及反應方程式計算反應速率;根據數據分析反應是否達到平衡。
2 L密閉容器中進行反應:pZ(g)+qQ(g) ![]() mX(g)+nY(g),式中m、n、p、q為化學計量數。在0~3 min內,各物質的物質的量的變化如下表所示:
mX(g)+nY(g),式中m、n、p、q為化學計量數。在0~3 min內,各物質的物質的量的變化如下表所示:
物質 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol | 0.8 |
已知:2 min內v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
請回答下列問題:
(1)2 min內X的濃度0.35 mol·L-1變為0.40 mol·L-1,所以v(X)=![]() =0.025 mol·L-1·min-1,
=0.025 mol·L-1·min-1,
故答案為:0.025 mol·L-1·min-1;
(2)v(Z)∶v(Y)=1∶2,則p:n=1∶2,2min內Z反應掉1mol-0.8mol=0.2mol,則同時生成Y為0.2mol×2=0.4mol,則起始時n(Y)=2.7mol-0.4mol=2.3 mol ,
故答案為:2.3 mol ;
(3) 2min末和3 min末Z的物質的量相等,則說明已經達到平衡,
故答案為:是;
(4)A.縮小容器體積,反應物濃度增大,正反應速率加快,故A正確;
B.移走部分Q,反應物濃度減小,正反應速率減小,故B錯誤;
C.通入大量He氣,反應物濃度不變,正反應速率不變,故C錯誤;
D.升高溫度,正反應速率加快,故D正確,
故答案為:AD。


 計算高手系列答案
計算高手系列答案科目:高中化學 來源: 題型:
【題目】下列示意圖與對應的反應情況符合的是
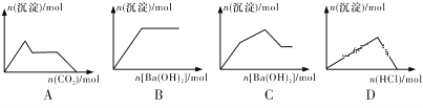
A. 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中緩慢通入CO2至過量
B. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至過量
C. 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至過量
D. 向NaAlO2溶液中逐滴加入鹽酸至過量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A. 放熱反應不需加熱即可發生
B. 化學反應過程中的能量變化除了熱能外,也可以是光能、電能等
C. 需要加熱才能進行的化學反應不一定是吸熱反應
D. 化學反應熱效應數值與參加反應的物質多少有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】開發新型儲氫材料是氫能源利用的重要研究方向之一。請回答以下問題:
(1)Ti(BH4)3是一種儲氫材料,可由TiCl4和LiBH4反應制得。
①基態Ti3+的電子排布式為____________________;LiBH4中Li、B、H元素的電負性由大到小的排列順序為_________________。
②另有一種含鈦元素的新型材料,其理論結構模型如圖所示,圖中虛線框內碳原子的雜化軌道類型為____________。

(2)氨硼烷(NH3BH3)是優良的儲氫材料,少量氨硼烷可以由硼烷(B2H6)和NH3合成。
①NH3BH3中是否存在配位鍵__________(填“是”或“否”);與NH3BH3互為等電子體的分子的化學式為__________。
②B、C、N與O元素的第一電離能由大到小的順序為___________________。
③氨硼烷在高溫下釋放氫后生成的立方氮化硼晶體,具有類似金剛石的結構,硬度略小于金剛石。則立方氮化硼晶體可用作___________(選填下列字母序號)。
a.切削工具 b.鉆探鉆頭 c.導電材料 d.耐磨材料
(3)一種有儲氫功能的銅合金晶體具有面心立方最密堆積的結構,晶胞中Cu原子處于面心,Au原子處于頂點位置,氫原子可進入到由Cu原子與Au原子構成的四面體空隙中。
①若將Cu原子與Au原子等同看待,該晶體儲氫后的晶胞結構與CaF2的結構相似,該晶體儲氫后的化學式為________________;
②銅與其它許多金屬及其化合物都可以發生焰色反應,其原因是_______________。
(4)金屬氫化物也是具有良好發展前景的儲氫材料。某儲氫材料是短周期金屬元素R的氫化物。R的部分電離能如下表所示:
I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
①該金屬元素是___________(填元素符號)..
②若氫化物的晶胞結構如圖所示(有4個H原子位于面上,其余H原子位于晶胞內),已知該晶體的密度為ρg·cm-3,則該晶胞的體積為__________cm3[用含ρ、NA的代數式表示(其中NA為阿伏加德羅常數的值)]。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國有廣闊的海岸線,建設發展海洋經濟、海水的綜合利用大有可為。
I.空氣吹出法工藝,是目前“海水提溴”的最主要方法之一。其工藝流程如下圖所示,試回答下列問題:
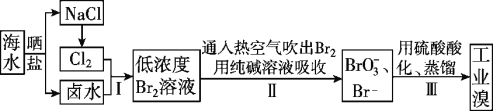
(1)以上步驟Ⅰ中已獲得游離態的溴,步驟Ⅱ又將之轉變成化合態的溴,其目的是____________。
(2)步驟②通入熱空氣或水蒸氣吹出Br2,利用了溴的________。
A.氧化性 B.還原性 C.揮發性 D.腐蝕性
(3)流程Ⅱ中涉及的離子反應方程式如下,請在下面橫線內填入適當的化學計量數:
___Br2+___![]() =___
=___![]() +___Br-+___CO2↑
+___Br-+___CO2↑
(4)上述流程中吹出的溴蒸氣,也可先用二氧化硫水溶液吸收,再用氯氣氧化后蒸餾。寫出溴與二氧化硫水溶液反應的離子方程式:___________________。
(5)流程Ⅲ蒸餾過程中,溫度應控制在80~90℃。溫度過高或過低都不利于生產,請解釋原因:_________。
Ⅱ.目前世界上60%的鎂是從海水中提取的。海水提鎂的主要流程如下:

(6)操作A是_____________,試劑a是_____________
(7)由無水MgCl2制取Mg的化學方程式是________________________。從考慮成本和廢物循環利用的角度,副產物可以用于_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為苯和溴的取代反應的改進實驗裝置圖。其中A為具支試管改制成的反應容器,在其下端開了一小孔,塞好石棉絨,再加入鐵屑粉少量。

填寫下列空白:(注:溴苯與NaOH溶液不可以發生水解反應)
(1)向反應容器A中逐滴加入溴和苯的混合液,幾秒鐘內就發生反應。寫出A中所發生反應的化學方程式(有機物寫結構簡式):________________________________________
(2)試管C中苯的作用是 ________________________________;反應開始后,觀察D試管,看到的現象為 _______________________________________;E中發生反應的離子方程式為: ___________________________________。
(3)反應2 min至3 min后,在B中的NaOH溶液底部可觀察到的現象是____________;
(4)在上述整套裝置中,具有防倒吸的儀器有________(填字母)。
(5)改進后的實驗除①步驟簡單,操作方便,成功率高;②各步現象明顯;③對產品便于觀察這3個優點外,還有一個優點是:_______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素W、X、Y、Z的原子序數依次增大。m、p、q、r、s是由這些元素組成的二元化合物,常溫常壓下r 為液體,其余均為無色氣體。m的摩爾質量為p的2倍,n是元素Y的單質,是綠色植物光合作用產生的無色氣體,p物質能使濕潤的紅色石蕊試紙變藍,q能使品紅溶液褪色。上述轉化關系如下圖所示。下列說法正確的是( )
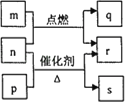
A. q與s均為酸性氧化物B. 原子半徑:W<Y<X
C. 非金屬性:W<Y< XD. Z的含氧酸是一種強酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,針對表中的①~⑨種元素,填寫下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在這些元素中,化學性質最不活潑的是:________(填具體元素符號,下同)。
(2)在最高價氧化物的水化物中,酸性最強的化合物的分子式是_______,堿性最強的化合物的電子式是:_______。
<>(3)最高價氧化物是兩性氧化物的元素是___;寫出它的氧化物與氫氧化鈉反應的離子方程式______。(4)用電子式表示元素④與⑥的化合物的形成過程:__________,該化合物屬于_____(填 “共價”或“離子”)化合物。
(5)表示①與⑦的化合物的電子式______________,該化合物是由_________(填“極性”“非極性”下同)鍵形成的。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com