
【題目】下表為短周期元素,表中所列序號分別代表一種元素。(除說明外都用化學用語填空)

(1)上述元素中金屬性最強和非金屬性最強的元素名稱分別是___、___;
(2)①和②的氣態氫化物穩定性較強的是(寫化學式):___;
(3)在上述元素中其最高價氧化物對應水化物酸性最強的酸為___;寫出⑤單質與③的最高價氧化物對應水化物反應的化學方程式為___。描述H2在⑧單質中燃燒的現象___。
(4)現有上表中某一種元素,其單質通入到紫色石蕊溶液中的現象為先變紅后褪色,該元素在周期表中的位置是___;
(5)比較②和③對應簡單離子的離子半徑較小的是(用相應離子符號表示)___。
(6)寫出③的最高價氧化物對應水化物的電子式___;其含有的化學鍵類型是___。
【答案】鈉 氟 HF HClO4 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 安靜的燃燒,發出蒼白色火焰,出現白霧 第三周期VIIA族 Na+ ![]() 離子鍵、極性鍵
離子鍵、極性鍵
【解析】
由元素在周期表中的位置,可確定①~⑨號元素分別為N、F、Na、Mg、Al、Si、P、Cl、Ar。
(1)依據同周期元素從左往右金屬性依次減弱,非金屬性依次增強,可推得上述元素中金屬性最強和非金屬性最強的元素名稱分別是鈉、氟。答案為:鈉;氟;
(2)①和②分別為N和F,非金屬性N<F,氣態氫化物穩定性較強的是HF。答案為:HF;
(3)在上述元素中,氯的最高價氧化物對應水化物酸性最強,此酸化學式為HClO4;⑤單質Al與③的最高價氧化物對應水化物NaOH反應,生成NaAlO2和H2,化學方程式為2Al+2NaOH+2H2O=2NaAlO2+3H2↑。描述H2在⑧單質Cl2中燃燒的現象為安靜的燃燒,發出蒼白色火焰,出現白霧。答案為:HClO4;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;安靜的燃燒,發出蒼白色火焰,出現白霧;
(4)現有上表中某一種元素,其單質通入到紫色石蕊溶液中的現象為先變紅后褪色,則該元素為氯,其電子排布為2、8、6,在周期表中的位置是第三周期VIIA族。答案為:第三周期VIIA族;
(5)②和③對應簡單離子為F-、Na+,二者的電子層結構相同,但Na的核電荷數比F大,所以離子半徑較小的是Na+。答案為:Na+;
(6)③的最高價氧化物對應水化物為NaOH,電子式為![]() ;其含有的化學鍵類型是離子鍵、極性鍵。答案為:
;其含有的化學鍵類型是離子鍵、極性鍵。答案為:![]() ;離子鍵、極性鍵。
;離子鍵、極性鍵。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】在CO2中,Mg燃燒生成MgO和C。下列說法正確的是( )
A. 元素C的單質只存在金剛石和石墨兩種同素異形體
B. Mg、MgO中鎂元素微粒的半徑:r(Mg2+)>r(Mg)
C. 在該反應條件下,Mg的還原性強于C的還原性
D. 該反應中化學能全部轉化為熱能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為CaF2、H3BO3(層狀結構,層內的H3BO3分子通過氫鍵結合)、金屬銅三種晶體的結構示意圖,請回答下列問題:


圖Ⅲ 銅晶體中銅原子堆積模型
(1)圖Ⅰ所示的CaF2晶體中與Ca2+最近且等距離的F-數為________________,圖Ⅲ中未標號的銅原子形成晶體后周圍最緊鄰的銅原子數為__________________________________。
(2)圖Ⅱ所示的物質結構中最外能層已達8電子結構的原子是________,H3BO3晶體中B原子個數與極性鍵個數比為____________。
(3)金屬銅具有很好的延展性、導電性、傳熱性,對此現象最簡單的解釋是用________理論。
(4)三種晶體中熔點最低的是________(填化學式),其晶體受熱熔化時,克服的微粒之間的相互作用為____________________________________________________________。
(5)已知兩個距離最近的Ca2+核間距離為a×10-8cm,結合CaF2晶體的晶胞示意圖,CaF2晶體的密度為_______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖是從元素周期表中截取下來的,甲、乙、丙為短周期主族元素,下列說法中正確的是( )
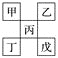
A. 丁一定是金屬元素,其金屬性比丙強
B. 丙的最高價氧化物水化物顯強酸性
C. 乙的氫化物是以分子形式存在,且分子間存在氫鍵
D. 戊的原子序數一定是甲的5倍,且原子半徑比甲大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第三代混合動力車,可以用電動機、內燃機或二者結合推動車輛。汽車上坡或加速時,電動機提供推動力,降低汽油的消耗;在剎車或下坡時,電池處于充電狀態,其電路工作原理如圖所示。下列說法中正確的是
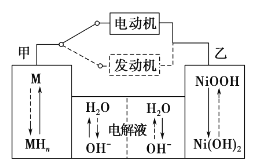
A. 放電時甲為負極,充電時為陽極
B. 電池充電時,OH—由甲側向乙側移動
C. 放電時負極的電極反應式為:MHn—ne—=M+nH+
D. 汽車下坡時發生圖中實線所示的過程
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,不能說明CO2是酸性氧化物的是( )
A.Na2CO3+H2SO4═CO2↑+H2O+Na2SO4
B.CO2+2NaOH═Na2CO3+H2O
C.CO2+2Mg![]() 2MgO+C
2MgO+C
D.CO2+Na2O=Na2CO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知SO3分解反應為2SO3(g)2SO2(g)+O2(g)。在1.0L密閉容器中加入10mol SO3(g),在一定溫度進行上述反應,反應時間(t)與容器內氣體總壓強(p)的數據見下表:
時間t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
總壓強p/kPa | 400 | 412 | 422 | 440 | 469 | 518 | 538 | 560 | 560 |
回答下列問題:
(1)欲提高SO3的平衡轉化率,應采取的措施為_____(填字母)。
a.增大壓強 b.通入SO3 c.降低壓強
(2)平衡時SO3的轉化率為_____,該溫度下的平衡常數Kw=_____
(3)研究表明,SO3(g)分解速率v=4×10﹣3×pSO3(kPamin﹣1),t=6h時,測得體系中pO2=55kPa,則此時的pSO3=_____kPa,v(SO3)=_____kPamin﹣1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三苯甲醇是有機合成中間體。實驗室用格氏試劑![]() )與二苯酮反應制備三苯甲醇。已知:①格氏試劑非常活潑,易與水、氧氣、二氧化碳等物質反應;
)與二苯酮反應制備三苯甲醇。已知:①格氏試劑非常活潑,易與水、氧氣、二氧化碳等物質反應;
②![]()
③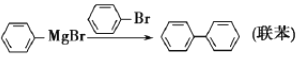
④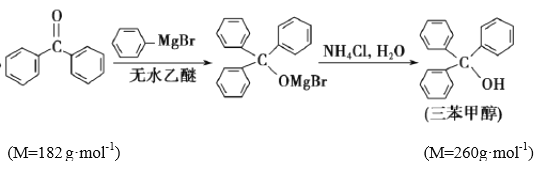
實驗過程如下
①實驗裝置如圖1所示。
a.合成格氏試劑:向三頸燒瓶中加入0.75g鎂屑和少量碘(引發劑),連接好裝置,在恒壓漏斗中加入3.20mL(0.03mol)溴苯和15.00mL乙醚混勻,開始緩慢滴加混合液,滴完后待用。
b.制備三苯甲醇:將5.50g二苯與15.00mL乙醚在恒壓漏斗中混勻,滴入三頸燒瓶。40℃左右水溶回流0.5h,加入20.00mL包和氯化銨溶液,使晶體析出。
②提純:圖2是簡易水蒸氣蒸餾裝置,用該裝置進行提純,最后冷卻抽濾
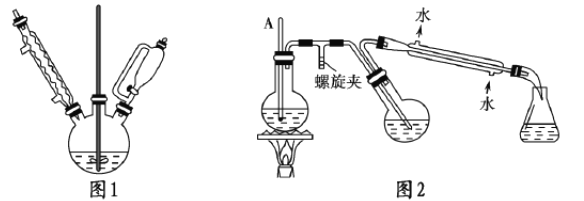
(1)圖1實驗中,實驗裝置有缺陷,應在球形冷凝管上連接____________裝置
(2)①合成格氏試劑過程中,低沸點乙醚的作用是____________________;
②合成格氏試劑過程中,如果混合液滴加過快將導致格氏試劑產率下降,其原因是______;
(3)提純過程中發現A中液面上升,此時應立即進行的操作是_______;
(4)①反應結束后獲得三苯甲醇晶體的操作為_______、過濾、洗滌______;
A.蒸發結晶 B.冷卻結晶 C.高溫烘干 D.濾紙吸干
②下列抽濾操作或說法正確的是_______
A.用蒸餾水潤濕濾紙,微開水龍頭,抽氣使濾紙緊貼在漏斗瓷板上
B.用傾析法轉移溶液,開大水龍頭,待溶液快流盡時再轉移沉淀
C.注意吸濾瓶內液面高度,當接近支管口位置時,撥掉橡皮管,濾液從支管口倒出
D.用抽濾洗滌沉淀時,應開大水龍頭,使洗滌劑快速通過沉淀物,以減少沉淀物損失
E.抽濾不宜用于過濾膠狀成劇粒太小的沉淀
(5)用移液管量取20.00mL飽和氯化較溶液,吸取液體時,左手______,右手持移液管;
(6)通過稱量得到產物4.00g,則本實驗產率為__________(精確到0.1%)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理解釋的是
A. 實驗室中常用排飽和食鹽水的方法收集Cl2
B. 對CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡體系增大壓強可使顏色變深
CO2(g)+NO(g),平衡體系增大壓強可使顏色變深
C. 升高溫度能夠促進水的電離
D. 在含有Fe(SCN)3的紅色溶液中加少量鐵粉,振蕩靜置,溶液顏色變淺
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com