
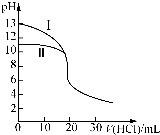
 室溫下,用0.10mol•L-1鹽酸分別滴定20.00mL 0.10mol•L-1氫氧化鈉溶液和氨水,滴定過程中溶液pH隨加入鹽酸體積[V(HCl)]的變化關系如圖所示.下列說法不正確的是( )
室溫下,用0.10mol•L-1鹽酸分別滴定20.00mL 0.10mol•L-1氫氧化鈉溶液和氨水,滴定過程中溶液pH隨加入鹽酸體積[V(HCl)]的變化關系如圖所示.下列說法不正確的是( )| A. | Ⅱ表示的是滴定氨水的曲線,當V(HCl)=20 mL時,有:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 當pH=7時,滴定氨水消耗的V(HCl)=20 mL,且c(NH4+)=c(Cl-) | |
| C. | 滴定氫氧化鈉溶液時,若V(HCl)>20 mL,則一定有:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 當滴定氨水消耗V(HCl)=10 mL時,有:2[c(OH-)-c(H+)]=c(NH4+)-c(NH3•H2O) |
分析 A.根據氨水和NaOH在滴定開始時的pH來判斷;
B.鹽酸與氨水恰好反應生成氯化銨,溶液顯酸性;
C.滴定氫氧化鈉溶液時,若V(HCl)>20 mL,氫離子濃度可能大于鈉離子;
D.當滴定氨水消耗V(HCl)=10 mL時,溶液中溶質為等物質的量的NH3•H2O和NH4Cl.
解答 解:A.一水合氨是弱堿,在溶液中部分電離,則開始時氨水的pH小于13,所以Ⅱ表示的是滴定氨水的曲線,當V(HCl)=20 mL時,恰好反應生成氯化銨,溶液顯酸性,則c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A正確;
B.滴定氨水消耗的V(HCl)=20 mL,鹽酸與氨水恰好反應生成氯化銨,溶液顯酸性,當pH=7時,滴定氨水消耗的V(HCl)<20 mL,故B錯誤;
C.滴定氫氧化鈉溶液時,若V(HCl)>20 mL,氫離子濃度可能大于鈉離子,則溶液中離子濃度關系可能為:c(Cl-)>c(H+)>c(Na+)>c(OH-),故C錯誤;
D.當滴定氨水消耗V(HCl)=10 mL時,溶液中溶質為等物質的量的NH3•H2O和NH4Cl,電荷守恒為c(Cl-)+c(OH-)=c(NH4+)+c(H+),物料守恒為:2c(Cl-)=c(NH3•H2O)+c(NH4+),則2[c(OH-)-c(H+)]=c(NH4+)-c(NH3•H2O),故D正確;
故選BC.
點評 本題考查酸堿混合的定性判斷和計算,題目難度中等,注意把握弱電解質的電離特點以及電荷守恒、物料守恒的應用方法,試題培養了學生的靈活應用能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 、O
、O 、Ca
、Ca .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 60周年國慶閱兵車HQE頂級紅旗采用全鋁車身,鋁的氧化物屬于兩性氧化物 | |
| B. | 用熱的純堿溶液洗滌沾有油污的器具時發生的主要是化學變化 | |
| C. | 英國華裔科學家高錕因在“光在纖維中的傳輸應用于光學通信方面”做出了突破性成就,而獲得了2009年諾貝爾物理學獎,光纖制品的基本原料為SiO2 | |
| D. | 液氨、液氯、液態氯化氫都是非電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 碳酸二甲酯資料 | |||||
| 簡稱 | 鍵線式 | 熔點 | 沸點 | 化學性質 | 用途 |
| DMC | 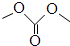 | 4℃ | 90.1℃ | 非常活潑、很易水解 毒性很低 | 有機合成中間體 |
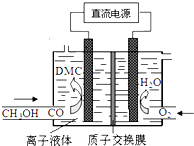 則下列說法正確的是( )
則下列說法正確的是( )| A. | 通O2區是陰極區,質子通過交換膜從陰極區移向陽極區 | |
| B. | 陽極反應:CO-2e-+2CH3OH═(CH3O)2CO+2H+ | |
| C. | 離子液體必須是水溶液,目的是傳遞電荷 | |
| D. | 電合成DMC的總反應方程式:CO+2CH3OH═(CH3O)2CO+H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 )結構
)結構 

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | lmol FeI2與足量氯氣反應時轉移的電子數為2NA | |
| B. | 2L 0.5 mol•L-1硫酸鉀溶液中陰離子所帶電荷數為NA | |
| C. | 1mol Na2O2固體中含離子總數為3NA | |
| D. | 標準狀況下,11.2L苯中含有分子的數目為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 常溫下,有些鹽如CaCl2、NaCl等物質的水溶液呈中性;有些鹽如Na2CO3等物質的水溶液呈堿性;有些鹽如NH4Cl等物質的水溶液呈酸性.現有HCl與CaCl2的混合溶液,向其中逐滴加入過量某物質X,溶液的pH隨滴入X的量的變化關系如圖所示.則X是( )
常溫下,有些鹽如CaCl2、NaCl等物質的水溶液呈中性;有些鹽如Na2CO3等物質的水溶液呈堿性;有些鹽如NH4Cl等物質的水溶液呈酸性.現有HCl與CaCl2的混合溶液,向其中逐滴加入過量某物質X,溶液的pH隨滴入X的量的變化關系如圖所示.則X是( )| A. | 水 | B. | 澄清石灰水 | C. | 純堿溶液 | D. | 稀鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | Y | |
| Z | W |
| A. | ZW3為非極性分子 | B. | 原子半徑:Z>X>Y | ||
| C. | W的單質是制取鹽酸的原料之一 | D. | XW3中W顯+1價 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com