
分析 ①碘化鉀和碘酸鉀在酸性條件下能發生氧化還原反應生成碘5KI+KIO3+6HCl=6KCl+3H2O+3I2;
該反應中KI是還原劑,還原劑對應的產物是氧化產物,KIO3是氧化劑,氧化劑對應的產物是還原產物,所以氧化產物、還原產物都是碘,物質的量之比為 5:1;該反應中有碘單質生成,碘遇淀粉變藍色,所以觀察到溶液變藍色;
②根據反應方程式找出關系式IO3-~3I2~6S2O32-,再利用滴定數據計算出碘酸鉀的質量,最后計算出1Kg食用鹽中含有的碘酸鉀質量,根據計算結果判定該鹽是否合格;硫代硫酸鈉屬于強堿弱酸鹽,溶液顯示堿性.
解答 解:①碘化鉀和碘酸鉀在酸性條件下能發生氧化還原反應生成碘5KI+KIO3+6HCl=6KCl+3H2O+3I2;該反應中KI是還原劑,還原劑對應的產物是氧化產物,KIO3是氧化劑,氧化劑對應的產物是還原產物,所以氧化產物、還原產物都是碘,物質的量之比為 5:1;
該反應中有碘單質生成,碘遇淀粉變藍色,所以觀察到溶液變藍色,
故答案為:5:1; 溶液變藍色;
②根據反應IO3-+5I-+6H+=3I2+3H2O,以及I2+2S2O32-(無色)→2I-+S4O62-(無色),得出反應的關系式IO3-~3I2~6S2O32-,
又n(Na2S2O3)=0.030mol/L×0.018L=0.00054mol,
則IO3-~3I2~6S2O32-
1 6
n(IO3-) 0.00054mol
解得:n(IO3-)=$\frac{1}{6}$×0.00054mol=0.00009mol,m(KIO3)=0.00009mol×214g/mol=0.01926g=1.926mg,
所以1kg食鹽中:m(KIO3)=$\frac{1000}{428}×1.926mg$=45mg,在40~50mg 之間,
所以該食鹽合格,
故答案為:45mg;是合格產品.
點評 本題考查較為綜合,氧化還原反應和離子反應的計算 及物質含量的測定,題目難度中等,解答時注意把握反應的關系式.


科目:高中化學 來源:2016-2017學年四川省高二上第一次月考化學卷(解析版) 題型:選擇題
NA代表阿伏伽德羅常數的值。下列說法正確的是
A.標準狀況下,22.4LCl2與足量的鐵粉反應,轉移的電子數為3NA
B.含23g鈉元素的Na2O和Na2O2混合物中陰離子數目介于0.5NA和NA之間
C.5NH4NO3 4N2↑+2HNO3 +9H2O中氧化產物比還原產物每多14g,轉移電子數為15NA
4N2↑+2HNO3 +9H2O中氧化產物比還原產物每多14g,轉移電子數為15NA
D.在0℃、101kPa條件下,11.2L丁烷中含極性共價鍵數目為5NA
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
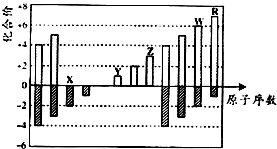
| A. | 原子半徑:Z<Y<X | |
| B. | 氣態氫化物的穩定性:R<W | |
| C. | WX3和水反應形成的化合物是離子化合物 | |
| D. | Y和Z兩者最高價氧化物對應的水化物能相互反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
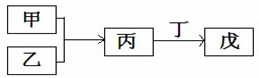 甲、乙、丙、丁、戊是中學常見的無機物,其中甲、乙為單質,它們的轉化關系如圖所示(某些條件和部分產物已略去).下列說法不正確的是( )
甲、乙、丙、丁、戊是中學常見的無機物,其中甲、乙為單質,它們的轉化關系如圖所示(某些條件和部分產物已略去).下列說法不正確的是( )| A. | 若甲、丙、戊含有同一種元素,則三種物質中,該元素的化合價由低到高的順序一定為:甲<丙<戊 | |
| B. | 若甲為短周期中原子半徑最大的主族元素的單質,且戊為堿,則丙可能為Na2O2 | |
| C. | 若丙、丁混合產生白煙,且丙分子為18電子分子,丁分子為10電子分子,則乙的水溶液可能具有漂白作用 | |
| D. | 若甲既能與鹽酸反應又能與NaOH溶液反應,則丙可能屬于兩性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3s23p8 | B. | 3d10 | C. | 3s23p64s2 | D. | 3s23p63d2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子最外層有3個電子的一種金屬 | |
| B. | 熔點低于100℃的一種金屬 | |
| C. | 次外電子層上有8個電子的一種元素 | |
| D. | 除最外層,原子的其他電子層電子數目均達飽和的一種金屬 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二者反應的平均速率相等 | B. | 二者溶質的物質的量濃度不相等 | ||
| C. | 二者生成二氧化碳的體積相等 | D. | 二者中氫離子的濃度不相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com