
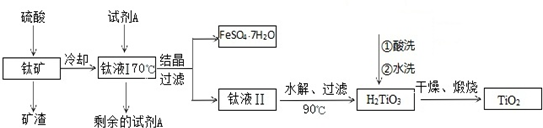
分析 (1)由酸溶、水解方程式可知均為未發生氧化還原反應,酸溶中生成FeSO4,可知FeTiO3中鐵的化合價;
(2)(3)加入硫酸后FeTiO3、Fe2O3溶解,SiO2不反應,過濾除去SiO2,由于亞鐵離子易被氧化,鈦液I加入試劑A,將溶液中Fe3+還原為Fe2+,超過90℃TiOSO4(aq)水解得到H2TiO3(s),冷卻至70℃左右結晶出硫酸亞鐵晶體,過濾分離出硫酸亞鐵晶體,鈦液Ⅱ水解析出H2TiO3(s),洗滌、干燥、灼燒得到TiO2;
(4)取少量酸洗后的H2TiO3,加入鹽酸并振蕩,滴加KSCN溶液后無明顯現象,再加H2O2后出現微紅色,說明H2TiO3中存在的雜質離子是亞鐵離子,直接水洗時Fe2+會水解得到氫氧化亞鐵,氧化得到氫氧化鐵,灼燒氫氧化鐵分解得到氧化鐵.
解答 解:加入硫酸后FeTiO3、Fe2O3溶解,SiO2不反應,過濾除去SiO2,由于亞鐵離子易被氧化,鈦液I加入試劑A,將溶液中Fe3+還原為Fe2+,超過90℃TiOSO4(aq)水解得到H2TiO3(s),冷卻至70℃左右結晶出硫酸亞鐵晶體,過濾分離出硫酸亞鐵晶體,鈦液Ⅱ水解析出H2TiO3(s),洗滌、干燥、灼燒得到TiO2;
(1)由酸溶、水解方程式可知均為未發生氧化還原反應,酸溶中生成FeSO4,可知FeTiO3中鐵的化合價為+2價,
故答案為:+2;
(2)因為礦石經硫酸溶解后得到的Fe2(SO4)3,而后面過濾得到的是FeSO4•7H2O,所以試劑A是鐵粉,
故答案為:鐵粉;
(3)由于TiOSO4容易水解,若溫度過高,則會有較多TiOSO4水解為固體H2TiO3,經過濾進入FeSO4•7H2O中,導致產品TiO2產率降低,
故答案為:由于TiOSO4容易水解,若溫度過高,則會有較多的TiOSO4水解為固體H2TiO3,而經過濾進入FeSO4•7H2O中,導致TiO2產率降低;
(4)取少量酸洗后的H2TiO3,加入鹽酸并振蕩,滴加KSCN溶液后無明顯現象,再加H2O2后出現微紅色,說明H2TiO3中存在的雜質離子是Fe2+離子,直接水洗時Fe2+會水解得到氫氧化亞鐵,氧化得到氫氧化鐵,灼燒氫氧化鐵分解得到氧化鐵,煅燒后獲得的TiO2發黃的雜質是Fe2O3,
故答案為:Fe2+;Fe2O3.
點評 本題屬于化學工藝流程題目,涉及對操作與試劑的分析評價、對原理的分析評價、物質的分離提純等,需要學生熟練掌握元素化合物知識,培養了學生實驗能力、知識遷移應用能力,難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | H-H | C-O | 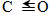 | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 876 | 465 | 413 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol Cl2與足量的NaOH溶液反應,轉移的電子數為2NA | |
| B. | 0.1molZn與含0.1molHCl的鹽酸充分反應,轉移的電子數目為0.2NA | |
| C. | 1molNa與足量O2反應,生成Na2O和Na2O2的混合物,轉移的電子數為NA | |
| D. | 向FeI2溶液中通入適量Cl2,當有1molFe2+被氧化時,共轉移的電子的數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
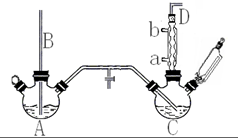 氯苯是重要的有機化工產品,是染料、醫藥、有機合成的中間體,工業上常用“間歇法”制取.反應原理、實驗裝置圖(加熱裝置都已略去)如下:
氯苯是重要的有機化工產品,是染料、醫藥、有機合成的中間體,工業上常用“間歇法”制取.反應原理、實驗裝置圖(加熱裝置都已略去)如下:
| 項目 | 二氯苯 | 尾氣 | 不確定苯耗 | 流失總量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 鋁粉投入NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | AlCl3溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將濕衣服放在太陽下曬干 | B. | 向較多粉塵的地面灑水后再清潔 | ||
| C. | 鐵制欄桿噴涂油漆 | D. | 將食鹽密封好,防止吸潮結塊 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com