
分析 (1)25℃時,KW=c(H+)•c(OH-)=10-7×10-7=10-14,兩種堿溶液混合,先計算出混合后溶液的c(OH-),再根據溶液的Kw計算出溶液的c(H+),然后根據PH=-lg(c(H+)求PH值;
(2)硫酸氫鈉與氯化鋇反應生成硫酸鋇沉淀、氯化氫、氯化鈉,反應過程中氫離子的物質的量不變,等體積混合后氫離子濃度變為原先的一半,然后根據pH=-lgc(H+)計算出混合液的pH;
(3)pH=4的強酸溶液中c(H+)=10-4mol/L,pH=11的強堿溶液中c(OH-)=10-3mol/L,混合液的pH=10,則混合溶液中c(OH-)=10-4mol/L=$\frac{C(O{H}^{-})V堿-C({H}^{+})V酸}{V酸+V堿}$,據此計算酸堿體積之比.
解答 解:(1)25℃時,KW=c(H+)•c(OH-)=10-7×10-7=10-14,pH=10的NaOH溶液中c(OH-)=1×10-4mol/L,pH=12的NaOH溶液中c(OH-)=1×10-2mol/L,混合后c(OH-)=$\frac{1{0}^{-4}+1{0}^{-2}}{2}$mol/L≈$\frac{1{0}^{-2}}{2}$mol/L,則溶液中的c(H+)=$\frac{{K}_{W}}{C(O{H}^{-})}$=$\frac{1{0}^{-14}}{\frac{1{0}^{-2}}{2}}$mol/L=2.0×10-12mol/L,所以PH=12-lg2=11.7,
故答案為:11.7;
(2)0.2mol/LNaHS04和0.1mol/LBaCl2溶液按等體積混合,反應過程中氫離子的物質的量不變,則混合液中氫離子濃度為硫酸氫鈉溶液中氫離子濃度的一半,即:c(H+)=$\frac{1}{2}$c(NaHS04)=$\frac{1}{2}$×0.2mol/L=0.1mol/L,混合液的pH=-lgc(H+)=-lg0.1=1,
故答案為:1;
(3)pH=4的強酸溶液中c(H+)=10-4mol/L,pH=11的強堿溶液中c(OH-)=10-3mol/L,混合液的pH=10,即混合后顯堿性,故應根據c(OH-)的濃度來計算.
設強酸的體積為aL,強堿的體積為bL,
則有:混合溶液中c(OH-)=10-4mol/L=$\frac{C(O{H}^{-})V堿-C({H}^{+})V酸}{V酸+V堿}$=$\frac{1{0}^{-3}mol/L×bL-1{0}^{-4}mol/L×aL}{(a+b)L}$解得a:b=9:2,故答案為:9:2.
點評 本題考查了溶液pH的簡單計算,注意兩種堿溶液混合后的溶液氫離子濃度計算,先計算溶液中c(OH-),再計算c(H+),注意硫酸氫鈉與氯化鋇混合過程中氫離子的物質的量不變,題目難度中等.


 天天練口算系列答案
天天練口算系列答案科目:高中化學 來源: 題型:解答題
 已知2NO2(g)═N2O4(g)△H(298K)=-52.7kJ•mol-1,某課外活動小組為了探究溫度和壓強對化學平衡的影響,做了如下兩組實驗:
已知2NO2(g)═N2O4(g)△H(298K)=-52.7kJ•mol-1,某課外活動小組為了探究溫度和壓強對化學平衡的影響,做了如下兩組實驗:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3COONa | B. | NaHCO3 | C. | NaCl | D. | NH4Cl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解氯化鎂溶液:2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 向AlCl3溶液中加入過量的氨水:Al3++4NH3.H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| C. | Cu與濃硝酸反應制備N02:3Cu+8H++2NO${\;}_{3}^{-}$═3Cu2++2NO2↑+4H2O | |
| D. | 向KAl(S04)2溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO${\;}_{4}^{2-}$+2Ba2++4OH-═AlO${\;}_{2}^{-}$+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題




查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 +2Na→
+2Na→ +H2↑
+H2↑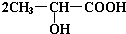 +Na2CO3→
+Na2CO3→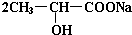 +H2O+CO2↑,
+H2O+CO2↑,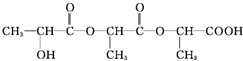

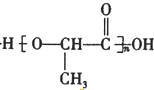
 $→_{△}^{濃硫酸}$CH2=CHCOOH+H2O.
$→_{△}^{濃硫酸}$CH2=CHCOOH+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2HCl+2Na═2NaCl+H2↑ | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl(濃)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A,B,C,D,E是五種短周期元素,A,B,C,D,E分別代表元素符號,他們的原子序數依次增大,A是元素周期表中半徑最小的元素;B元素最高價氧化物對應的水化物與其氫化物反應生成一種鹽;D與A同主族,且與E同周期;E元素最外層電子數是其次外層電子數的$\frac{3}{4}$;C與E同主族.請回答下列問題:
A,B,C,D,E是五種短周期元素,A,B,C,D,E分別代表元素符號,他們的原子序數依次增大,A是元素周期表中半徑最小的元素;B元素最高價氧化物對應的水化物與其氫化物反應生成一種鹽;D與A同主族,且與E同周期;E元素最外層電子數是其次外層電子數的$\frac{3}{4}$;C與E同主族.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 溫度 | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com