
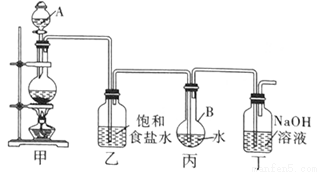
(1)寫出裝置甲中發生反應的化學方程式: 。
裝置甲中的儀器使用前需要檢漏的有 (寫名稱)。
(2)利用裝置丙制取飽和氯水并測其pH值。
①證明氯水已飽和的現象是 。
②測定飽和氯水的pH方法是 。
③若撤去裝置乙,直接將裝置甲和丙相連。這樣做對實驗測定結果的影響是 。
(3)飽和氯水與石灰石的反應是制取較濃的HClO溶液的方法之一。某同學運用這一方法,嘗試制取HClO溶液并進行了如下定性實驗:
i.在試管中加入過量的塊狀碳酸鈣,再加入約20ml飽和氯水,充分反應,有少量氣泡產生,溶液的黃綠色褪去;
ii.過濾,將濾液滴在有色布條上,發現其漂白性更強;
iii.為了確定反應產物,將濾液分為三份,分別進行以下實驗:
第一份與石灰水混合,立即產生大量白色沉淀;
第二份與稀鹽酸混合,立刻產生大量氣泡;
第三份加熱,看到溶液變渾濁且有大量無色氣體產生。
經檢測,上述實驗中產生的無色氣體均為CO2氣體。
② 試解釋可以在飽和氯水中加入石灰石制備HClO的原因: 。(用有關的方程式結合文字回答)
②試根據所學知識推測,在ii的濾液中含有的溶質,除了溶解的極少量氯氣外,還含有的其他溶質為 (寫化學式)。
③寫出步驟iii中第一份濾液發生反應的離子方程式: 。
科目:高中化學 來源:2015-2016學年吉林省高二下學期基礎訓練(15)化學試卷(解析版) 題型:填空題
(1)質量相同的O2、NH3、H2、Cl2四種氣體中,在相同溫度和相同壓強條件下,體積最大的是 。
(2)下列物質中,既能與鹽酸反應,又能與氫氧化鈉溶液反應的是 。(填序號)
①NaAlO2②Ca(OH)2③Na2CO3④Al(OH)3⑤NaHCO3⑥Si
(3)氯水中含有多種成分。將紫色石蕊試液滴入氯水中,溶液顯紅色起作用的成分是 ;過一會兒,溶液顏色逐漸褪去,起作用的成分是 ;
(4)已知:Fe2+的還原性強于Br—,標準狀況下把11.2L氯氣通入500ml 0.8mol/L FeBr2溶液中,寫出反應完全后的離子方程式 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高二下學期基礎訓練(15)化學試卷(解析版) 題型:選擇題
將氯化鈉、氯化鋁、氯化亞鐵、氯化鐵、氯化鎂五種溶液,通過一步實驗就能加以區別,并只用一種試劑,這種試劑是
A. KSCN B. BaCl2 C. NaOH D. HCl
查看答案和解析>>
科目:高中化學 來源:2016-2017學年陜西省西安市高一上學期期末考試化學試卷(解析版) 題型:選擇題
下列離子方程式或電離方程式的書寫正確的是( )
A. NaHSO4熔融:NaHSO4 = Na++H++SO42-
B. Al(OH)3酸式電離:Al(OH)3 = 3OH—+Al3+
C. 向Na2CO3溶液中滴入少量稀鹽酸:CO32-+2H+ = H2O+CO2↑
D. Ca(HCO3)2溶液與少量NaOH溶液反應:OH-+HCO +Ca2+ = CaCO3↓+H2O
+Ca2+ = CaCO3↓+H2O
查看答案和解析>>
科目:高中化學 來源:2016-2017學年陜西省西安市高一上學期期末考試化學試卷(解析版) 題型:選擇題
用NA表示阿伏加德羅常數的值,下列說法中正確的是( )
A. 28g N2所含有的原子數為NA
B. 標準狀況下,22.4 L水中含有的水分子數為NA
C. 500 mL 1.0 mol/L碳酸鈉溶液中所含Na+的數為0.5NA
D. 49g純硫酸所含有的氧原子數與標況下22.4L CO2中所含有的氧原子數相等
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省衡陽市高二理科實驗班下學期第一次月考理綜化學試卷(解析版) 題型:選擇題
將反應5IO3-+I-+6H+ 3I2+3H2O設計成如下圖所示的原電池。開始時向甲燒杯中加入少量濃硫酸,電流計指針發生偏轉,一段時間后,電流計指針回到零,再向甲燒杯中滴入幾滴濃NaOH溶液,電流計指針再次發生偏轉。
3I2+3H2O設計成如下圖所示的原電池。開始時向甲燒杯中加入少量濃硫酸,電流計指針發生偏轉,一段時間后,電流計指針回到零,再向甲燒杯中滴入幾滴濃NaOH溶液,電流計指針再次發生偏轉。
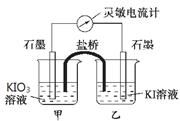
下列判斷不正確的是
A. 開始加入少量濃硫酸時,乙中石墨電極上發生氧化反應
B. 開始加入少量濃硫酸時,同時在甲、乙燒杯中都加入淀粉溶液,只有乙燒杯中溶液變藍。
C. 電流計讀數為零時,反應達到化學平衡狀態
D. 兩次電流計指針偏轉方向相反
查看答案和解析>>
科目:高中化學 來源:2017屆河南省天一大聯考高三階段性測試(四)(b卷)理綜化學試卷(解析版) 題型:簡答題
碳及其化合物在人們的日常生活、工農業生產及科學研究中有著重要的作用。回答下列有關問題:
(1)煤炭是人們利用最為廣泛的燃料,但因煤炭含硫而導致大氣污染。對燃煤煙氣中的SO2可采用碳酸鈣漿液法吸收,即把燃煤煙氣和空氣同時鼓入到含CaCO3的漿液中,使SO2被吸收。①該反應生成石膏(CaSO4 •2H2O),化學方程式為____________________。
②標準狀況下,某種煙氣中SO2含量為2.1×10-3g •L-1,則反應中轉移3 mol電子時,處理標
準狀況下煙氣的體積為___________L(保留兩位有效數字)。
(2)工業煉鐵的基本原理是:在高溫下,焦炭燃燒生成的CO將鐵礦石中鐵的氧化物還原得到鐵。
已知:
①Fe2O3(s)+3C(s,石墨)==2Fe(s)+3CO(g) △H= +489.0 kJ• mol-1;
②C(s,石墨)+CO2(g) ==2CO(g) △H= +172.5 kJ• mol-1。
則CO還原Fe2O3(s)的熱化學方程式為_______________________。
(3)碳酸二甲酯(DMC)是一種無毒、環保性能優異、用途廣泛的化工原料。一定溫度時,在容積為1.0 L的恒容密閉容器中充入2.5molCH3OH(g)、適量CO2和5×10-3催化劑,容器中發生反應:2CH3OH(g) +CO2(g)  CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ• mol-1。甲醇轉化數(TON)與反應時間的關系如圖1所示:
CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ• mol-1。甲醇轉化數(TON)與反應時間的關系如圖1所示:
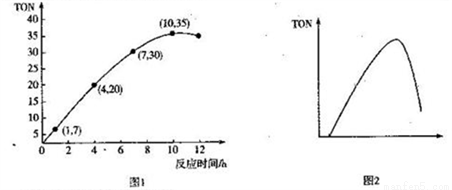
已知:TON=
①該溫度時,甲醇的最高轉化率為_______________。
② 0 ~7 h內DMC的平均反應速率是_______mol·L-1·h-1(保留兩位有效數字)。
③圖2是甲醇轉化數隨某種物理量的變化曲線,該物理量可能是_______;為使該反應向正
反應方向移動,可采取的措施有______________________。(答出一條即可)。
(4)CO2溶解于水形成碳酸。碳酸與次氯酸的電離常數如下表所示:
弱酸 | 碳酸 | 次氯酸 |
電離常數(Ka) | Ka1=4.4×l0-7 Ka2=5.6×10-11 | 3.0×10-8 |
在NaClO溶液中通入少量CO2 ,反應的離子方程式為_____________________,0.03 mol • L-1 NaClO 溶液的 pH=________________。
查看答案和解析>>
科目:高中化學 來源:浙江省衢州市2017屆高三1月教學質量檢測化學試卷 題型:選擇題
向含amolNaOH和amolNa2CO3的混合溶液中通入bmolCO2充分反應(不考慮CO2的溶解),下列說法不正確的是
A. 當a≥2b時,發生的離子反應為:2OH-+CO2=CO32-+H2O
B. 當a=1.25b時,發生的離子方程式為:5OH-+4CO2=3HCO3-+CO32-+H2O
C. 2b/3<a<2b時,溶液中CO32-與HCO3-物質的量之比為:(2b-a):(2a-b)
D. 若反應后溶液中CO32-與OH-物質的量之比為2:1,則5b=a
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省南京市高二學業水平模擬測試化學試卷(解析版) 題型:選擇題
下列關于乙醇性質的說法正確的是
A. 乙醇是無色無味的液體 B. 乙醇能使紫色石蕊試液變紅
C. 乙醇不能與金屬鈉反應 D. 乙醇能被酸性高錳酸鉀溶液氧化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com