
已知某溫度下,無水Na2CO3的溶解度是10.0 g/(100 g水)。在該溫度下,向足量的飽和Na2CO3(aq)中加入1.06 g無水Na2CO3,攪拌后靜置。試求最終所得晶體的質量。
3.45 g
解答本題有兩種方法,一是過程思維法,二是終態思維法。
方法1(過程思維法):先求加入的1.06 g無水Na2CO3形成并析出晶體的質量m1(Na2CO3·10H2O)及溶液中由此減少的水的質量m1(H2O)
Na2CO3 ~ Na2CO3·10H2O ~ 10H2O
106 g 286 g 180 g
1.06 g m1(Na2CO3·10H2O) m1(H2O)
m1(Na2CO3·10H2O)=2.86 g m1(H2O)=1.80 g
再求溶解在1.80 g水中Na2CO3的質量m2(Na2CO3),及這些Na2CO3析出所形成晶體的質量m2(Na2CO3·10H2O)和溶液由此而減少水的質量m2(H2O)
m2(Na2CO3)=![]() =0.180 g
=0.180 g
Na2CO3 ~ Na2CO3·10H2O ~ 10H2O
106 g 286 g 180 g
0.180 g m2(Na2CO3·10H2O) m2(H2O)
m2(Na2CO3·10H2O)=0.486 g m2(H2O)=0.306 g
依次類推,求m3(Na2CO3)及m3(Na2CO3·10H2O)和m3(H2O),直至所得晶體質量mi(Na2CO3·10H2O)在![]() (Na2CO3·10H2O)的和中可以忽略為止。
(Na2CO3·10H2O)的和中可以忽略為止。
m3(Na2CO3)=![]() =0.0306 g
=0.0306 g
Na2CO3 ~ Na2CO3·10H2O ~ 10H2O
106 g 286 g 180 g
0.0306 g m3(Na2CO3·10H2O) m3(H2O)
m3(Na2CO3·10H2O)=0.0826 g m3(H2O)=0.0520 g
m4(Na2CO3)=![]() =0.00520 g
=0.00520 g
m4(Na2CO3·10H2O)=![]() =0.0140 g
=0.0140 g
……(生成固體質量以0.170倍遞減)
最后得出所得晶體質量m(Na2CO3·10H2O)
m(Na2CO3·10H2O)=![]() (Na2CO3·10H2O)
(Na2CO3·10H2O)
=2.86 g+0.486 g+0.0826 g+0.0140 g+……
=3.44 g
方法2(終態思維法):設最終析出Na2CO3·10H2O的質量為x,則其中含有Na2CO3和水的質量分別為:
m(Na2CO3)=![]() m(H2O)=
m(H2O)=![]()
這樣,若將(![]() -1.06 g) Na2CO3溶解在質量為
-1.06 g) Na2CO3溶解在質量為![]() 的水中,在題設溫度下,當形成飽和溶液,所以:
的水中,在題設溫度下,當形成飽和溶液,所以:
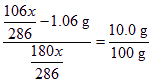 x=3.45 g。
x=3.45 g。


 名校名師培優作業本加核心試卷系列答案
名校名師培優作業本加核心試卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化學 來源: 題型:閱讀理解

| 1 |
| 2 |
| 3 |
| 2 |
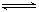 2CO2的平衡常數為K1;反應4Fe+3O2
2CO2的平衡常數為K1;反應4Fe+3O2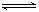 2Fe2O3的平衡常數K2,則反應3CO+Fe2O3
2Fe2O3的平衡常數K2,則反應3CO+Fe2O3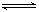 2Fe+3CO2的平衡常數K與K1、K2的關系式
2Fe+3CO2的平衡常數K與K1、K2的關系式
|
|
| ||
| ||
| n(C) |
| n(Fe2O3) |
| n(C) |
| n(Fe2O3) |
| n(C) |
| n(Fe2O3) |
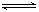 HSO3-+OH-
HSO3-+OH-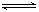 HSO3-+OH-
HSO3-+OH-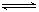 2AlCl3(g)+3CO(g)△H>0,欲提高金屬鋁的氯化效果,不可采取的措施是
2AlCl3(g)+3CO(g)△H>0,欲提高金屬鋁的氯化效果,不可采取的措施是查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| MgO | Al2O3 | MgCl2 | AlCl3 | |
| 熔點/℃ | 2852 | 2072 | 714 | 190(2.5×105Pa) |
| 沸點/℃ | 3600 | 2980 | 1412 | 182.7 |

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 實驗 編號 |
T/K | 反應 時間/h |
反應物的物質的量配比 n[CO(NH2)2]:n[MgCl2?6H2O] |
實驗目的 |
| ① | 378 | 3 | 3:1 | (Ⅰ)實驗①和③探究 反應物的物質的量配比對產率的影響 反應物的物質的量配比對產率的影響 刪除此空 刪除此空 ;(Ⅱ)實驗②和④探究 溫度對產率的影響 溫度對產率的影響 ;(Ⅲ)實驗②和 ③ ③ 探究反應時間對產率的影響. |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |

查看答案和解析>>
科目:高中化學 來源:模擬題 題型:填空題
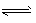 N2O4(g)的平衡常數K=___,若NO2的起始濃度為2 mol/L,且初始時無N2O4,其他條件保持不變,則NO2的最大轉化率為___。
N2O4(g)的平衡常數K=___,若NO2的起始濃度為2 mol/L,且初始時無N2O4,其他條件保持不變,則NO2的最大轉化率為___。 查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com