
 H2 (g) +CO2 (g)平衡常數K隨溫度的變化如下表:
H2 (g) +CO2 (g)平衡常數K隨溫度的變化如下表:
 2CO (g)平衡常數K1;
2CO (g)平衡常數K1; CO(g) +H2 (g)平衡常數K2則K、K1、K2,之間的關系是 :
CO(g) +H2 (g)平衡常數K2則K、K1、K2,之間的關系是 :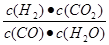 。根據表中的數據可知,隨著溫度的升高,平衡常數K是減小的,這說明升高溫度平衡向逆反應方向進行,所以正方應是放熱反應,即△H<0。
。根據表中的數據可知,隨著溫度的升高,平衡常數K是減小的,這說明升高溫度平衡向逆反應方向進行,所以正方應是放熱反應,即△H<0。 H2 (g) +CO2 (g),所以平衡常數之間的關系是K=K2/K1。
H2 (g) +CO2 (g),所以平衡常數之間的關系是K=K2/K1。 H2 (g) +CO2 (g)
H2 (g) +CO2 (g)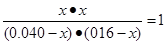
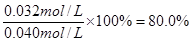
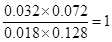 ,所以反應仍然是平衡狀態,則正逆反應速率相等。
,所以反應仍然是平衡狀態,則正逆反應速率相等。

 陽光同學一線名師全優好卷系列答案
陽光同學一線名師全優好卷系列答案科目:高中化學 來源:不詳 題型:單選題
| A.在500℃、20MPa、5L的密閉容器中進行合成氨的反應,使用催化劑后K值增大 |
| B.室溫下K(HCN)<K(CH3COOH),說明CH3COOH的電離度一定比HCN大 |
| C.25℃時,pH 均為4的鹽酸和NH4I(aq)中KW不相等 |
D.2SO2+O2 2SO3達平衡后,改變某一條件K值不變,SO2的轉化率可能增大、減小或不變 2SO3達平衡后,改變某一條件K值不變,SO2的轉化率可能增大、減小或不變 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.除去苯中的少量苯酚,向混合物中加入適量的溴水后過濾 |
| B.某溫度時,純水中c(H+)=2×10-7mol·L-1,則c(OH-)=5×10-8mol·L-1 |
C.N2(g)+3H2(g) 2NH3(g),其他條件不變,增大壓強,v(正)增大而v(逆)減小 2NH3(g),其他條件不變,增大壓強,v(正)增大而v(逆)減小 |
D.Na2CO3溶液中存在平衡:CO32-+H2O HCO3-+OH一,升高溫度溶液堿性增強 HCO3-+OH一,升高溫度溶液堿性增強 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2SO3(g),反應混合體系在平衡狀態時SO3的百分含量與溫度的關系如下圖所示。下列說法錯誤的是
2SO3(g),反應混合體系在平衡狀態時SO3的百分含量與溫度的關系如下圖所示。下列說法錯誤的是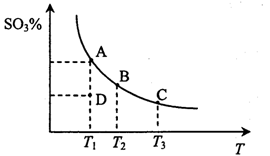
 2SO3(g)的△H<0
2SO3(g)的△H<0查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 cZ(g)的影響,將X和Y以物質的量之比為a:b開始反應,通過實驗得到不同條件下達到平衡時Z的物質的量分數,實驗結果如圖所示。 下列判斷正確的是
cZ(g)的影響,將X和Y以物質的量之比為a:b開始反應,通過實驗得到不同條件下達到平衡時Z的物質的量分數,實驗結果如圖所示。 下列判斷正確的是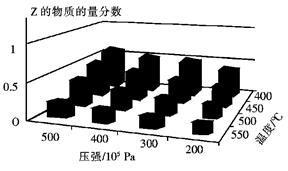
| A.△H<0,a+b>c |
| B.△H>0,a+b<c |
| C.△H>0,a+b>c |
| D.△H<0,a+b<c |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 H2(g)+I2(g)已達平衡狀態的是
H2(g)+I2(g)已達平衡狀態的是 | A.①③⑤ | B.②⑥ | C.④⑤ | D.④⑥⑦ |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 N2O4(g) 達到平衡的標志是
N2O4(g) 達到平衡的標志是 | A.①② | B.①②③ | C.③④ | D.①③④ |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 pC(g) △H,結合圖中所給的信息填空。
pC(g) △H,結合圖中所給的信息填空。
 ______
______
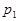 ______
______
 ______
______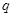
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
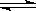 cC(g)的平衡體系中,無論升高溫度或降低壓強,C的濃度都會增大,則以下說法正確的是
cC(g)的平衡體系中,無論升高溫度或降低壓強,C的濃度都會增大,則以下說法正確的是 | A.a+b<c正反應吸熱 | B.a+b>c正反應吸熱 |
| C.a+b>c正反應放熱 | D.a+b<c正反應放熱 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com