SO
2是大氣主要污染物,是形成酸雨的主要物質.某校學習小組對有關問題進行了探究:
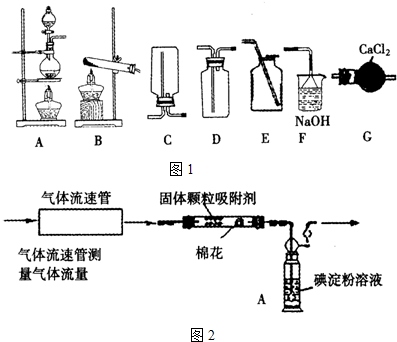
(Ⅰ)已知反應:Na
2SO
3(固)+H
2SO
4(濃)
Na
2SO
4+SO
2↑+H
2O學習小組依據此反應來制備SO
2,并設計了如圖1裝置,則制備收集SO
2并防止污染空氣,選擇的裝置從左至右的順序為
.
(Ⅱ)測定硫酸廠尾氣中SO
2含量(不考慮尾氣中的SO
3).
方案甲 化學學習小組設計了如圖2裝置來測定硫酸廠尾氣中SO
2含量. 通入氣體,A中顏色變淺.當A中顏色變為無色時,停止通入氣體.
(1)A中發生的離子反應方程式為:
.
(2)A中的試劑可用其它試劑替代,試寫出一種可替代的試劑為
.
(3)當A中顏色變為無色時沒有及時停止通氣體,則測得的SO
2含量
.(填偏高、偏低或不變)
(4)若氣體流速為a L/min,A中c(I
2)=6mol/L,溶液體積為VL.2分鐘時A中顏色變為無色. 則標準狀況下SO
2的體積百分含量為
(假設通入的SO
2被完全吸收).
方案乙 學習小組設計了如下方案:尾氣
溶液
固體
某同學認為該方案無需使用H
2O
2,可直接將SO
2通入過量的Ba(OH)
2溶液中.你認為該同學是否正確并說明理由
.

 期末寶典單元檢測分類復習卷系列答案
期末寶典單元檢測分類復習卷系列答案