
下列A―L 11種物質是中學化學常見物質,其中C、D、E、F為氣體,C、D、H為單質。1 mol FeC2O4在反應①中轉移1 mol電子。它們有如下圖所示的轉化關系(部分反應中的生成物已略去),試回答:
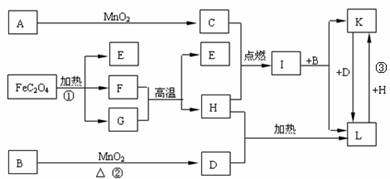
(1)寫出有關物質的化學式:A__________、I____________。
(2)寫出反應①中化學方程式_____________________________________________。
(3)寫出反應②中化學方程式_____________________________________________。
(4) 寫出反應③中的離子方程式 _____________________________________ 。
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(11分)(2011·濱州模擬)Ⅰ.回答下列有關常數的問題:
(1)Kw的數學表達式是________,溫度升高Kw________(選填“變大”“變小”或“不變”),若定義pOH=-lgc(OH-),則pH+pOH=________(用含Kw的代數式表示)。
(2)Ka通常表示弱酸的電離平衡常數,Ka值越大表示該弱酸的酸性________。α通常稱為電離度,顧名思義是表示弱電解質的電離程度大小的一個指標,對于某一元弱酸,當用蒸餾水稀釋該酸時,Ka________(選填“變大”“變小”或“不變”)。α________(選填“變大”“變小”或“不變”)。
(3)Ksp表示難溶物的溶度積常數,該常數越大表示________。
Ⅱ.已知常溫下,AgBr的Ksp=4.9×10-13mol2·L-2、AgI的Ksp=8.3×10-17mol2·L-2。
(1)現向含有AgI的飽和溶液中:
①加入固體AgNO3,則c(I-)________(填“變大”“變小”或“不變”,下同);
②若改加更多的AgI,則c(Ag+)________;
③若改加AgBr固體,則c(I-)______;而c(Ag+)______。
(2)有關難溶鹽的溶度積及溶解度(與AgBr、AgI無關),有以下敘述,其中正確的是________。
A.兩種難溶鹽電解質,其中Ksp小的溶解度一定小
B.向含有AgCl固體的溶液中加入適量的水使AgCl溶解又達到平衡時,AgCl的溶度積不變,其溶解度也不變
C.將難溶電解質放入純水中,溶解達到平衡時,電解質離子的濃度的乘積就是該物質的溶度積
D.溶液中存在兩種可以與同一沉淀劑生成沉淀的離子,則Ksp小的一定先生成沉淀
E.難溶鹽電解質的Ksp與溫度有關
F.同離子效應(加入與原電解質具有相同離子的物質),使難溶鹽電解質的溶解度變小,也使Ksp變小
(3)現向含有NaBr、KI均為0.002 mol·L-1的溶液中加入等體積的濃度為4×10-3 mol/L AgNO3溶液,則產生的沉淀是________(填化學式);若向其中再加入適量的NaI固體,則最終可發生沉淀轉化的總反應方程式表示為:______________________________。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年陜西寶雞金臺區高二上學期期中質量檢測化學試卷(帶解析) 題型:填空題
在25℃時,2L的密閉容器中A、B、C三種氣體的初始濃度和平衡濃度如下表:
| 物 質 | A | B | C |
| 初始濃度/mol·L-1 | 1.0 | 2.0 | 0 |
| 2min時,平衡濃度/mol·L-1 | 0.4 | 0.2 | 1.2 |

查看答案和解析>>
科目:高中化學 來源:2012屆高考化學一輪復習《溶液中的離子反應》專題綜合測試(蘇教版) 題型:實驗題
(11分)(2011·濱州模擬)Ⅰ.回答下列有關常數的問題:
(1)Kw的數學表達式是________,溫度升高Kw________(選填“變大”“變小”或“不變”),若定義pOH=-lgc(OH-),則pH+pOH=________(用含Kw的代數式表示)。
(2)Ka通常表示弱酸的電離平衡常數,Ka值越大表示該弱酸的酸性________。α通常稱為電離度,顧名思義是表示弱電解質的電離程度大小的一個指標,對于某一元弱酸,當用蒸餾水稀釋該酸時,Ka________(選填“變大”“變小”或“不變”)。α________(選填“變大”“變小”或“不變”)。
(3)Ksp表示難溶物的溶度積常數,該常數越大表示________。
Ⅱ.已知常溫下,AgBr的Ksp=4.9×10-13mol2·L-2、AgI的Ksp=8.3×10-17mol2·L-2。
(1)現向含有AgI的飽和溶液中:
①加入固體AgNO3,則c(I-)________(填“變大”“變小”或“不變”,下同);
②若改加更多的AgI,則c(Ag+)________;
③若改加AgBr固體,則c(I-)______;而c(Ag+)______。
(2)有關難溶鹽的溶度積及溶解度(與AgBr、AgI無關),有以下敘述,其中正確的是________。
| A.兩種難溶鹽電解質,其中Ksp小的溶解度一定小 |
| B.向含有AgCl固體的溶液中加入適量的水使AgCl溶解又達到平衡時,AgCl的溶度積不變,其溶解度也不變 |
| C.將難溶電解質放入純水中,溶解達到平衡時,電解質離子的濃度的乘積就是該物質的溶度積 |
| D.溶液中存在兩種可以與同一沉淀劑生成沉淀的離子,則Ksp小的一定先生成沉淀 |
查看答案和解析>>
科目:高中化學 來源:2011-2012學年高考化學一輪復習《溶液中的離子反應》專題綜合測試(蘇教版) 題型:實驗題
(11分)(2011·濱州模擬)Ⅰ.回答下列有關常數的問題:
(1)Kw的數學表達式是________,溫度升高Kw________(選填“變大”“變小”或“不變”),若定義pOH=-lgc(OH-),則pH+pOH=________(用含Kw的代數式表示)。
(2)Ka通常表示弱酸的電離平衡常數,Ka值越大表示該弱酸的酸性________。α通常稱為電離度,顧名思義是表示弱電解質的電離程度大小的一個指標,對于某一元弱酸,當用蒸餾水稀釋該酸時,Ka________(選填“變大”“變小”或“不變”)。α________(選填“變大”“變小”或“不變”)。
(3)Ksp表示難溶物的溶度積常數,該常數越大表示________。
Ⅱ.已知常溫下,AgBr的Ksp=4.9×10-13mol2·L-2、AgI的Ksp=8.3×10-17mol2·L-2。
(1)現向含有AgI的飽和溶液中:
①加入固體AgNO3,則c(I-)________(填“變大”“變小”或“不變”,下同);
②若改加更多的AgI,則c(Ag+)________;
③若改加AgBr固體,則c(I-)______;而c(Ag+)______。
(2)有關難溶鹽的溶度積及溶解度(與AgBr、AgI無關),有以下敘述,其中正確的是________。
A.兩種難溶鹽電解質,其中Ksp小的溶解度一定小
B.向含有AgCl固體的溶液中加入適量的水使AgCl溶解又達到平衡時,AgCl的溶度積不變,其溶解度也不變
C.將難溶電解質放入純水中,溶解達到平衡時,電解質離子的濃度的乘積就是該物質的溶度積
D.溶液中存在兩種可以與同一沉淀劑生成沉淀的離子,則Ksp小的一定先生成沉淀
E.難溶鹽電解質的Ksp與溫度有關
F.同離子效應(加入與原電解質具有相同離子的物質),使難溶鹽電解質的溶解度變小,也使Ksp變小
(3)現向含有NaBr、KI均為0.002 mol·L-1的溶液中加入等體積的濃度為4×10-3 mol/L AgNO3溶液,則產生的沉淀是________(填化學式);若向其中再加入適量的NaI固體,則最終可發生沉淀轉化的總反應方程式表示為:______________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com