
【題目】NA為阿伏加德羅常數,關于a g亞硫酸鈉晶體(Na2SO37H2O)的說法中正確的是
A.含Na+數目為![]() NAB.含氧原子數目為
NAB.含氧原子數目為![]() NA
NA
C.完全氧化SO32-時轉移電子數目為![]() NAD.含結晶水分子數目為
NAD.含結晶水分子數目為![]() NA
NA
【答案】D
【解析】
A. a g亞硫酸鈉晶體(Na2SO37H2O)的物質的量n=![]() mol,而1 mol Na2SO37H2O中含2molNa+,故
mol,而1 mol Na2SO37H2O中含2molNa+,故![]() mol Na2SO37H2O中含
mol Na2SO37H2O中含![]() mol,即
mol,即![]() mol鈉離子,A錯誤;
mol鈉離子,A錯誤;
B. a g亞硫酸鈉晶體(Na2SO37H2O)的物質的量n=![]() mol,而1 mol Na2SO37H2O中含10 mol氧原子,故
mol,而1 mol Na2SO37H2O中含10 mol氧原子,故![]() mol Na2SO37H2O中含氧原子
mol Na2SO37H2O中含氧原子![]() mol,即含有
mol,即含有![]() mol的O原子,B錯誤;
mol的O原子,B錯誤;
C. SO32-被氧化時,由+4價被氧化為+6價,即1 mol SO32-轉移2 mol電子,故![]() mol Na2SO37H2O轉移
mol Na2SO37H2O轉移![]() mol 電子,C錯誤;
mol 電子,C錯誤;
D. 1 mol Na2SO37H2O中含7 mol水分子,故![]() mol Na2SO37H2O中含水分子數目為
mol Na2SO37H2O中含水分子數目為![]() mol×7×NA/mol=
mol×7×NA/mol=![]() NA,D正確;
NA,D正確;
故合理選項是D。


 出彩同步大試卷系列答案
出彩同步大試卷系列答案科目:高中化學 來源: 題型:
【題目】煅燒黃鐵礦(主要成分為FeS2)所得的礦渣中含Fe2O3、SiO2、Al2O3、MgO等.用該礦渣可制備鐵紅(Fe2O3).完成下列填空:
(1)煅燒黃鐵礦的化學方程式____,反應過程中被氧化的元素____.
(2)礦渣中屬于兩性氧化物的是___,寫出Fe2O3與稀硫酸反應的離子方程式__.
(3)Al(OH)3的堿性比Mg(OH)2的堿性___(選填“強”或“弱”);鋁原子最外層電子排布式為____.
(4)SiO2的熔點___ Fe2O3的熔點(填“大于”或“小于”),原因是__.
(5)已知礦渣質量為w kg,若鐵紅制備過程中,鐵元素損耗25%,最終得到鐵紅的質量為m kg,則原來礦渣中鐵元素質量分數為______(用表達式表示).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是
A.![]() 和CO的混合物共
和CO的混合物共![]() ,其中碳原子的數目為NA
,其中碳原子的數目為NA
B.![]() 重水
重水![]() 分子中含有的中子數為0.8NA
分子中含有的中子數為0.8NA
C.![]() 放入過量的98%濃
放入過量的98%濃![]() 中,轉移電子數為3NA
中,轉移電子數為3NA
D.![]()
![]() 的NaCl溶液中微粒數大于0.5NA
的NaCl溶液中微粒數大于0.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組同學通過實驗研究FeCl3溶液與Cu粉發生的氧化還原反應。實驗記錄如下:
序號 | I | II | III |
實驗 步驟 |
充分振蕩,加2mL蒸餾水 |
充分振蕩,加入2mL蒸餾水 |
充分振蕩,加入2mL蒸餾水 |
實驗 現象 | 銅粉消失,溶液黃色變淺,加入蒸餾水后無明顯現象 | 銅粉有剩余,溶液黃色褪去,加入蒸餾水后生成白色沉淀 | 銅粉有剩余,溶液黃色褪去,變成藍色,加入蒸餾水后無白色沉淀 |
下列說法不正確的是( )
A.實驗I、II、III中均發生了反應2Fe3++Cu===2Fe2++Cu2+
B.對比實驗I、II、III說明白色沉淀的產生可能與銅粉的量及溶液的陰離子種類有關
C.實驗II、III中加入蒸餾水后c(Cu2+)相同
D.向實驗III反應后的溶液中加入飽和NaCl溶液可能出現白色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近日,各地媒體紛紛報道了有“火鍋紅”、“火鍋飄香劑”、“辣椒精”等造就的“化學火鍋”的新聞,食品添加劑的使用引起了人們的注意,亟待規范。
乙偶姻是一種應用較廣泛的香料.乙偶姻(相對分子質量為88)中只含有C、H、O三種元素,其原子個數比為2:4:1,乙偶姻中含有碳氧雙鍵.與乙偶姻有關的反應如下:
已知:HO﹣RCH﹣CHR’﹣OH![]() RCHO+R’CHO
RCHO+R’CHO
(1)乙偶姻的分子式為__,G的結構簡式為__;
(2)反應①、②的反應類型為:①__、②__;
(3)D→E反應的化學方程式為________________;
B→C反應的化學方程式為___________________;
(4)X是乙偶姻的同分異構體,屬于酯類,寫出2種X可能的結構簡式:______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知H2CO3的電離常數:K1=4.4×10-7,K2=4.7×10-11,HClO的電離常數:2.95×10-8。反應:Cl2+H2O![]() HCl+HClO達到平衡后,要使c(HClO)增大可加入( )
HCl+HClO達到平衡后,要使c(HClO)增大可加入( )
A.NaOHB.HClC.CaCO3(固體)D.H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應:3A(g)![]() 3B(?)+C(?) ΔH>0,隨著溫度升高,氣體平均相對分子質量有減小趨勢,則下列判斷正確的是( )
3B(?)+C(?) ΔH>0,隨著溫度升高,氣體平均相對分子質量有減小趨勢,則下列判斷正確的是( )
A.B和C可能都是固體B.B和C一定都是氣體
C.若C為固體,則B一定是氣體D.B和C一定都不是氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】自來水生產過程中,可用氯氣等物質作消毒劑,明礬等物質作絮凝劑。出廠的自來水中含少量可溶性礦物質。完成下列填空:
(1)自來水中含硫量約70 mg/L,它只能以______(填微粒符號)形態存在,不能以其它形態存在的原因是________________________。
(2)已知在堿性條件下,氯氣會發生自身氧化還原反應,某反應體系中的物質為:KClO3、Cl2、KCl、KOH、H2O。
①寫出該反應的化學方程式。____________________________。
②該反應中氧化劑與還原劑的質量比為_________。
(3)實驗室利用反應6HCl+KClO3 → KCl+3H2O+3Cl2↑制取Cl2,當產生標準狀況下的氣體3.36 L時,轉移電子_____mol。
(4)不同環境中,物質的性質可能會有所不同。根據上述兩題的反應中KClO3和Cl2的氧化性強弱比較,你能得出的結論是________________________。
(5)鋁銨礬[NH4Al(SO4)212H2O]也是常用的工業凈水劑,其凈水的化學原理是________________(用離子方程式表示)。
(6)在向鋁銨礬溶液中逐滴滴加氫氧化鋇溶液的過程中,下列關系可能正確的是_________。(選填編號)
a.n(SO42-)>n(NH4+)>n(A13+)>n(OH-)
b.n(A13+)>n(NH4+)>n(SO42-)>n(H+)
c.n(BaSO4)>n[A1(OH)3]>n(NH3·H2O)>n(A1O2-)
d.n(NH3·H2O)>n(BaSO4)>n[A1(OH)3]>n(A1O2-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在水溶液中1 mol Cl-、ClO![]() (x=1,2,3,4)的能量(kJ)相對大小如圖所示。D是____(填離子符號)。B→A+C的熱化學方程式為____________(用離子符號表示)。
(x=1,2,3,4)的能量(kJ)相對大小如圖所示。D是____(填離子符號)。B→A+C的熱化學方程式為____________(用離子符號表示)。
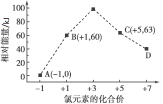
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com