
已知反應H2(g)+ I2(g)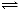 2HI(g),1 mol H2完全反應放出a kJ的熱量,依據下表數據,以下說法錯誤的是( )
2HI(g),1 mol H2完全反應放出a kJ的熱量,依據下表數據,以下說法錯誤的是( )
化 學 鍵 | H—H | I—I |
斷開1 mol化學鍵時吸收的能量(kJ) | b | c |
A.該反應中反應物的總能量高于生成物的總能量
B.斷開1 mol H-H 鍵和1 mol I-I 鍵所需能量大于斷開2 mol H-I 鍵所需能量
C.斷開2 mol H-I鍵所需能量為(a+b+c)kJ
D.向密閉容器中加入2 mol H2和2 mol I2,充分反應后放出的熱量小于2a kJ
科目:高中化學 來源:2015-2016學年山東省濟寧市高一下期末化學試卷(解析版) 題型:填空題
四種短周期元素A、B、C、D的性質或結構信息如下:
信息:①原子半徑:A>B>C>D ②四種元素之間形成的某三種分子的比例模型及部分性質如下:
甲: 是地球上最常見的物質之一,是所有生命體生存的重要資源,約占人體體重的三分之二。
是地球上最常見的物質之一,是所有生命體生存的重要資源,約占人體體重的三分之二。
乙: 無色,無氣味并且易燃。是常見的一種基礎能源。
無色,無氣味并且易燃。是常見的一種基礎能源。
丙: 有強氧化性的弱酸,可以用于消毒殺菌。
有強氧化性的弱酸,可以用于消毒殺菌。
請根據上述信息回答下列問題。
(1)B元素在元素周期表中的位置為________________,請寫出BC2分子的電子式:_______________。
(2)A所在周期中,E元素的單質還原性最強,F元素的某些鹽類常用作凈水劑。E單質與甲反應有化合物X生成。請寫出以下兩個反應的離子方程式:
①A元素的單質與物質甲發生反應:_____________________________________。
②F、C兩種元素組成的化合物Y可作為高溫結構陶瓷材料,X與Y兩種化合物在溶液中發生反應:______________________________________________________。
(3)物質丁的元素組成和甲相同,丁分子具有18電子結構。向盛有一定濃度丁溶液的試管中,逐滴加入硫酸酸化的硫酸亞鐵溶液。滴加過程中的現象為:
①試管中溶液變成深棕黃色,發生反應的離子方程式為 ;
②開始有少量氣泡出現(經驗證是氧氣),片刻后反應變得劇烈,繼續滴加溶液,靜置一段時間,試管底部出現紅褐色沉淀。請回答“片刻后反應變得劇烈”的原因是a b
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧省撫順市協作校高一下期末化學試卷(解析版) 題型:填空題
甲醇是重要的化工原料。利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇,發生的主要反應如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列問題:
(1)CO2的電子式是 。
(2)△H1= kJ/mol,①反應正向的熵變△S 0(填>、<或=)。
(3)在容積為2L的密閉容器中,充入一定量CO2和H2合成甲醇(上述②反應),在其他條件不變時,溫度T1、T2對反應的影響圖像如圖,下列說法正確的是__________(填序號)
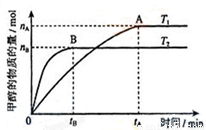
①溫度為T1時,從反應到平衡,生成甲醇的平均速率為:v(CH3OH)=nA/tA mol/(L·min)
②當v(CH3OH) = v(H2O)時,說明反應達到平衡
③混合氣體的平均相對分子質量A點大于B點
④處于A點的反應體系從T1變到T2,達到平衡時n(H2)與n(CH3OH)比值增大
(4)在T1溫度時,將2molCO2和6molH2充入2L密閉容器中,充分反應(上述②反應)達到平衡后,若CO2轉化率為50%,,則容器內的壓強與起始壓強之比為__________;T1溫度,反應CH3OH(g)+H2O(g)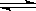 CO2(g)+3H2(g)的平衡常數數值為__________。
CO2(g)+3H2(g)的平衡常數數值為__________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧省撫順市協作校高一下期末化學試卷(解析版) 題型:選擇題
a、b、c、d均為短周期元素,a的原子中只有1個電子,b2-和c+離子的電子層結構相同,b與d同主族。下列敘述正確的是
A. a分別與b、c、d形成的二元化合物中a的化合價均為+1
B. b與其他三種元素均可形成至少兩種二元化合物
C. a與b形成的化合物中一定只有共價鍵,b與c形成的化合物中一定只有離子鍵
D. 原子半徑大小順序d>c>b>a
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧省大連市高一下期末化學試卷(解析版) 題型:填空題
A、B、C、D、E、F六種短周期主族元素,A的簡單離子焰色反應為黃色。B的最高價氧化物對應水化物B(OH)2 5.8 g恰好能與100 mL 2 mol·L-1鹽酸完全反應;且B原子核中質子數和中子數相等。E2在黃綠色氣體C2中燃燒產生蒼白色火焰。D原子的最外層電子數是次外層電子數的3倍,F和D同主族。 根據上述條件回答:
(1)寫出元素B的名稱 ,元素C在元素周期表中的位置 。
(2)A、D形成淡黃色化合物,該物質中含有的化學鍵類型為 。
(3)C2與ADE溶液反應的離子方程式為 。
(4)用電子式表示BC2的形成過程 。
(5)由元素D和E構成的9e-微粒名稱是 。
(6)比較元素C和F的氣態氫化物的穩定性 > (用化學式表示)。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧省大連市高一下期末化學試卷(解析版) 題型:選擇題
下列敘述正確的是( )
A.聚氯乙烯與乙烯性質相似,可使溴水褪色
B.甲烷和Cl2的反應與乙烯和Br2的反應屬于同一類型的反應
C.C5H11Cl有8種同分異構體
D.相同條件下,熔沸點:正丁烷<異丁烷
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧省大連市高一下期末化學試卷(解析版) 題型:選擇題
用分液漏斗可以分離的一組混合物是( )
A.溴苯和水 B.乙酸乙酯和乙酸
C.溴乙烷和乙醇 D.乙醇和水
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣東省肇慶市高二下期末化學試卷(解析版) 題型:選擇題
實驗測得-25℃時干冰晶體(面心結構)的晶胞邊長為acm,其摩爾質量為Mg/mol,則該干冰晶體的密度為(單位:g/cm3)
A.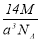 B.
B.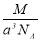 C.
C.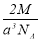 D.
D.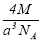
查看答案和解析>>
科目:高中化學 來源:2015-2016學年新疆伊犁州伊寧二中高二下期末化學試卷(解析版) 題型:選擇題
元素X、Y、Z在周期表中的相對位置如圖所示。已知Y元素原子的外圍電子排布為ns(n-1)np(n+1),則下列說法不正確的是( )
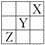
A. Y元素原子的外圍電子排布為4s24p4
B. Y元素在周期表的第三周期ⅥA族
C. X元素所在周期中所含非金屬元素最多
D. Z元素原子的核外電子排布式為1s22s22p63s23p63d104s24p3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com