

分析 (1)依據原電池反應原理分析,氧化還原反應中鐵離子在正極得到電子發生還原反應,碘離子再負極失電子發生氧化反應,負極所在電解質溶液為KI溶液,正極所在電解質溶液為FeCl3溶液,據分析填寫圖中內容;
(2)原電池中發生還原反應的為正極,是鐵離子得到電子生成亞鐵離子;
(3)反應達到平衡后,無電子轉移,無電流形成;
(4)增大亞鐵離子濃度平衡逆向進行,原電池反應是碘單質和亞鐵離子反應,亞鐵離子失電子發生氧化反應為原電池負極;
(5)鐵離子遇到硫氰化鉀顯示紅色;亞鐵離子能使高錳酸鉀褪色,據此檢驗離子的存在.
解答 解:(1)依據原電池反應原理分析,氧化還原反應中鐵離子在正極得到電子發生還原反應,碘離子再負極失電子發生氧化反應,負極所在電解質溶液為KI溶液,正極所在電解質溶液為FeCl3溶液,原電池裝置為: ;
;
故答案為: ;
;
(2)原電池中發生還原反應的為正極,是鐵離子得到電子生成亞鐵離子,電極反應為:Fe3++e-=Fe2+;
故答案為:正;Fe3++e-=Fe2+;
(3)反應達到平衡后,無電子轉移,無電流形成,故答案為:無;
(4)平衡后向FeCl3溶液中加入少量FeCl2固體,增大亞鐵離子濃度平衡逆向進行,原電池反應是碘單質和亞鐵離子反應,亞鐵離子失電子發生氧化反應為原電池負極;當固體全部溶解后,則此溶液中電極變為負極;
故答案為:負;
(5)取少量待檢液于試管中,加入硫氰化鉀,顯紅色,說明有Fe3+;另取少量待檢液于試管中,加入酸性高錳酸鉀溶液,若溶液退色,則有Fe2+,故答案為:取少量待檢液于試管中,加入硫氰化鉀,顯紅色,說明有Fe3+;另取少量待檢液于試管中,加入酸性高錳酸鉀溶液,若溶液退色,則有Fe2+.
點評 本題考查了原電池原理的分析應用,為高頻考點,側重于學生的分析能力的考查,注意把握電極反應電極判斷,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 鈉與水反應:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 大理石與醋酸:CaCO3+2H+=Ca2++H2O+CO2 | |
| C. | 碳酸氫鈣溶液中加入石灰水:Ca2++2HCO3-+2OH-=CaCO3+CO32-+2H2O | |
| D. | 明礬溶于水:Al3++3H2O?Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
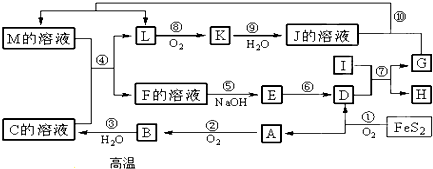
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2:1 | B. | 3:2 | C. | 3:4 | D. | 5:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Z的氧化物與水反應可制得相應的含氧酸 | |
| B. | X、Y、W的最高價氧化物對應水化物之間互相都能發生反應 | |
| C. | X、Y、W的原子半徑依次減小,對應的離子半徑依次增大 | |
| D. | Z的氫化物的熱穩定性強于W的氫化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
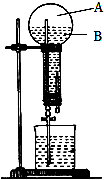 如圖是做過氨氣溶于水的噴泉實驗裝置,實驗完成后燒瓶里的空間被分為兩個部分:A和B,請根據實驗內容按要求填空:
如圖是做過氨氣溶于水的噴泉實驗裝置,實驗完成后燒瓶里的空間被分為兩個部分:A和B,請根據實驗內容按要求填空: NH4++OH-(用離子方程式表示);
NH4++OH-(用離子方程式表示);查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),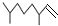 (3,7-二甲基-1-辛烯),家蠶的性信息素為:CH3(CH2) 8CH═CH-CH═CH(CH2)8CH3.下列說法不正確的是( )
(3,7-二甲基-1-辛烯),家蠶的性信息素為:CH3(CH2) 8CH═CH-CH═CH(CH2)8CH3.下列說法不正確的是( )| A. | 2,4-二甲基-1-庚烯的分子式為C9H18 | |
| B. | 以上三種信息素均能使溴的四氯化碳溶液褪色 | |
| C. | 2,4-二甲基-1-庚烯與3,7-二甲基-1-辛烯互為同系物 | |
| D. | 1 mol家蠶的性信息素與1 mol Br2加成,產物只有一種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氣的燃燒熱為285.5 kJ•mol-1,則其燃燒的熱化學方程式為:2H2(g)+O2(g)=2H2O(l)△H=-285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ•mol-1,則石墨的燃燒熱為110,5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2 NH3(g)△H=-92.4 kJ•mol-1,由于△H<0,故該反應一定能自發進行 | |
| D. | 熱化學方程式中的化學計量數表示物質的量,可以是分數 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com