
【題目】表為元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列問題:
(1)Z元素在周期表中的位置為__.
(2)表中元素原子半徑最大的是(寫元素符號)__.
(3)下列事實能說明Y元素的非金屬性比S元素的非金屬性強的是__.
a.Y單質與H2S溶液反應,溶液變渾濁
b.在氧化還原反應中,1mol Y 單質比1mol S 得電子多
c.Y和S兩元素的簡單氫化物受熱分解,前者的分解溫度高
(4)X與Z兩元素的單質反應生成1mol X 的最高價化合物,恢復至室溫,放熱687kJ.已知該化合物的熔沸點分別為﹣69℃和58℃,寫出該反應的熱化學方程式:__.
(5)銅與一定濃度的硝酸和硫酸的混合酸反應,生成的鹽只有硫酸銅,同時生成的兩種氣體均由上表中的兩種元素組成,氣體的相對分子質量都小于50.為防止污染,將生成的氣體完全轉化為最高價含氧酸鹽,消耗1L 2.2mol/L NaOH 溶液和1mol O2,則兩種氣體的分子式分別為__,物質的量分別為__,生成硫酸銅物質的量為__.
【答案】 第三周期,第ⅤⅡA族 Si ac Si(s)+2Cl2(g)=SiCl4(l)△H=﹣687kJ/mol NO、NO2 0.9mol、1.3mol 2mol
【解析】根據元素周期表結構可知,X為硅(Si)元素,Y為氧(O)元素,Z為(Cl)元素。
(1)Z為Cl元素,其原子序數為17,原子結構示意圖為:![]() ,因此Z位于周期表中第三周期,ⅤⅡA族;
,因此Z位于周期表中第三周期,ⅤⅡA族;
故答案為:第三周期,第ⅤⅡA族;
(2)元素周期表中,同一周期從左向右,原子半徑逐漸減小,同一主族從上到下,原子半徑逐漸增大;則原子半徑最大的為Si,
故答案為:Si;
(3)比較非金屬性的強弱,可以根據元素單質氧化性強弱或氫化物穩定性來比,而與得失電子數目無關。a.Y單質與H2S溶液反應,溶液變渾濁,說明Y單質將H2S氧化為S單質,Y單質的氧化性比硫強,可說明Y元素的非金屬性比S元素強,故a正確;b.在氧化還原反應中,得失電子數目與氧化性強弱無關,不能作為非金屬性強弱比較的一句,故b錯誤;c.元素的非金屬性越強,氫化物的穩定性越強,Y和S兩元素的簡單氫化物受熱分解,前者的分解溫度高,說明Y的氰化物更穩定,Y的非金屬性較強,故c正確。
故答案為:ac;
(4)X(Si)與Z(Cl)兩元素的單質反應生成1molX的最高價化合物SiCl4,恢復至室溫,放熱687kJ,又已知該化合物的熔、沸點分別為﹣69℃和58℃,則常溫下SiCl4為液態,該反應的熱化學方程式為:Si(s)+2Cl2(g)=SiCl4(l)△H=﹣687kJ/mol。
故答案為:Si(s)+2Cl2(g)=SiCl4(l)△H=﹣687kJ/mol;
(5)銅與一定濃度的硝酸和硫酸的混合酸反應可能生成NO2和NO,相對分子質量都小于50,符合題意。為防止污染,消耗1L 2.2mol/L NaOH 溶液和1mol O2,將生成的氣體完全轉化為NaNO3。根據N原子守恒,可得n(NaNO3)=n(NO2)+n(NO)=n(NaOH)。銅與酸反應的過程中,銅失去的電子數應等于HNO3所得電子數,還原產物NO2和NO又被O2氧化為NaNO3,N的電子轉移至O2,可以理解為銅的電子最后進入O2。故根據原子守恒和電子守恒列式計算。
設NO2的物質的量為x,NO的物質的量為y,
則n(NaNO3)=n(NO2)+n(NO)=n(NaOH)
n(e-) = n(O2)×4=n(NO2)×1+n(NO)×3=n(Cu) ×2
即2.2=x+y,4=x+3y,
解得:x=1.3mol,y=0.9mol。
參與反應的Cu的物質的量為:n(Cu)= 2mol。
故答案為:NO 0.9mol,NO2 1.3mol;2mol。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】“電解質的溶液中所有陽離子所帶的正電荷數與所有陰離子所帶的負電荷數相等,故顯電中性,常稱電荷守恒”.某鹽的溶液中含有Na+、Mg2+、Cl﹣、SO ![]() 四種離子,若Na+為0.2mol,Mg2+為0.4mol,Cl﹣ 為0.4mol,則SO
四種離子,若Na+為0.2mol,Mg2+為0.4mol,Cl﹣ 為0.4mol,則SO ![]() 物質的量為( )
物質的量為( )
A.0.1mol
B.0.3mol
C.0.5mol
D.0.15mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了探究鐵和硫反應產物中鐵的化合價為+2價或+3價或既有+2也有+3價,某同學設計了如下圖所示的實驗過程:(已知硫會溶于熱堿溶液)
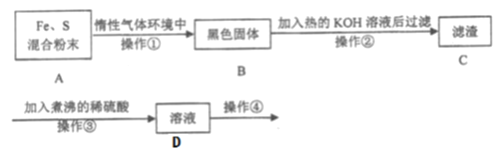
請回答以下問題:
(1)混合粉末A中S粉必須要過量,其原因是為了保證鐵粉完全反應,從而避免_____。
(2)反應在“惰性氣體環境中”進行的原因是______________________。
(3)操作①是用燒熱的玻璃棒點觸混合粉末,反應即可持續進行,這說明了_______。
(4)操作②的作用是________________________________________。
(5)操作③中稀硫酸煮沸的目的是____________________________________。
(6)為探究產物中鐵的價態,需要繼續對D溶液進行實驗,請寫出操作④的具體操作、現象及結論:__________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上電解制堿的技術是用離子交換膜法,主要原料是飽和食鹽水.請回答下列問題:
(1)陽離子交換膜把電解槽隔成了陰極室和陽極室,電解食鹽水時,它只允許__ (填離子符號)通過.
(2)為了去除粗鹽中混有的Ca2+、Mg2+、SO42﹣,下列選項中所加試劑(均為溶液)及加入順序均合理的是__ (填選項字母)
A.先加足量的BaCl2,再加足量的Na2CO3,最后加入適量稀鹽酸
B.先加入足量的NaOH,再加入足量的BaCl2,然后加入足量Na2CO3,最后加入適量稀鹽酸
C.先加足量的Na2CO3,再加足量的BaCl2,然后加足量的NaOH,最后加入適量稀鹽酸
D.先加足量的Ba(NO3)2,再加足量NaOH,然后再加足量的Na2CO3,最后加入適量稀鹽酸
(3)氯堿工業是高耗能產業,一種將電解池與燃料電池相組合的新工藝可以節電能30%以上.在這種工藝設計中,相關物料的傳輸與轉化關系如圖所示,其中的電極未標出,所用的離子交換膜都只允許陽離子通過.

①圖中X是__ (填化學式),分析比較圖示中a、b、c從大到小的順序為__.
②寫出燃料電池中負極上發生的電極反應式__.
③這樣設計的主要節電能之處在于(任寫出一條)__.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用碳及其化合物的性質,完成下列小題:
(1)長期存放石灰水的瓶子內會出現一層白色固體,請分析這層白色固體產生的原因(用化學方程式表示);用完石灰水后,怎樣除去瓶壁上的白色固體,(用化學方程式表示).
(2)除去碳酸鈉固體中少量碳酸氫鈉的方法是(用化學方程式表示):
(3)向碳酸氫鈉溶液滴加NaOH溶液,發生反應的離子方程式為: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各物質,所含原子數目最多的是( )
A.標準狀況下,22.4L甲烷
B.標準狀況下,44.8L氮氣和氧氣的混合氣體
C.常溫常壓下,66g二氧化碳氣體
D.100mL 1mol/L硫酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1.52g銅鎂合金完全溶解于50mL密度為1.40gmL﹣1、質量分數為63%的濃硝酸中,得到NO2和N2O4的混合氣體 1 120mL(標準狀況),向反應后的溶液中加入1.0molL﹣1NaOH溶液,當金屬離子全部沉淀時,得到2.54g沉淀.下列說法不正確的是
A. 得到2.54 g沉淀時,加入NaOH溶液的體積是640 mL
B. 該濃硝酸中HNO3的物質的量濃度是14.0 molL﹣1
C. NO2和N2O4的混合氣體中,NO2的體積分數是80%
D. 該合金中銅與鎂的物質的量之比是1:2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com