
食鹽中的抗結劑是亞鐵氰化鉀,其化學式為K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O樣品受熱脫水過程的熱重曲線(樣品質量隨溫度的變化曲線)如下圖所示。

試回答下列問題:
(1)試確定150 ℃時固體物質的化學式_____________。
(2)查閱資料知:雖然亞鐵氰化鉀自身毒性很低,但其水溶液與酸反應放出極毒的氰化氫(HCN)氣體;亞鐵氰化鉀加熱至一定溫度時能分解產生氰化鉀(KCN)。據此判斷,烹飪食品時應注意的問題為_____________________________________________________。
(3)在Fe2+、Fe3+的催化作用下,可實現2SO2+O2+2H2O=2H2SO4的轉化。已知,含SO2的廢氣通入含Fe2+、Fe3+的溶液中時,其中一個反應的離子方程式為4Fe2++O2+4H+=4Fe3++2H2O,則另一個反應的離子方程式為__________________________。
(4)已知Fe(OH)3的溶度積常數Ksp=1.1×10-36。室溫時在FeCl3溶液中滴加NaOH溶液,當溶液pH為3時,通過計算說明Fe3+是否沉淀完全_____________。
(提示:當某離子濃度小于10-5 mol·L-1時可以認為該離子沉淀完全)
科目:高中化學 來源: 題型:閱讀理解
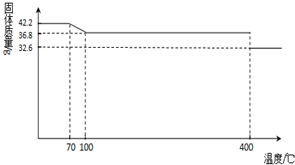 (2013?德州模擬)食鹽中的抗結劑是亞鐵氰化鉀,其化學式為K4[Fe(CN)6]?3H2O.
(2013?德州模擬)食鹽中的抗結劑是亞鐵氰化鉀,其化學式為K4[Fe(CN)6]?3H2O.查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
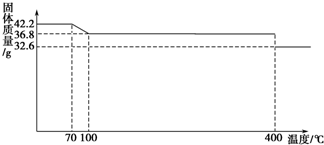
(14分)食鹽中的抗結劑是亞鐵氰化鉀,其化學式為K4[Fe(CN)6]•3H2O。
42.2g K4[Fe(CN)6] •3H2O樣品受熱脫水過程的熱重曲線(樣品質量隨溫度的變化曲線)如下圖所示。
試回答下列問題:
(1)試確定150℃時固體物質的化學式為_______________。
(2)查閱資料知:雖然亞鐵氰化鉀自身毒性很低,但其水溶液與酸反應放出極毒的氰化氫(HCN)氣體;亞鐵氰化鉀加熱至一定溫度時能分解產生氰化鉀(KCN)。據此判斷,烹飪食品時應注意的問題為___________________________________。
(3)在25℃下,將a mol•L-1的KCN(pH>7)溶液與0.01mol•L-1的鹽酸等體積混合,反應平衡時,測得溶液pH=7,則KCN溶液的物質的量濃度a_______0.01mol•L-1(填“>”、“<”或“=”);用含a的代數式表示HCN的電離常數Ka=______________。
(4)在Fe2+、Fe3+的催化作用下,可實現2SO2+O2+2H2O=2H2SO4的轉化。已知,含SO2的廢氣通入Fe2+、Fe3+的溶液時,其中一個反應的離子方程式為4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,則另一反應的離子方程式為 。則上述轉化的重要意義在于 。
(5)已知Fe(OH)3的溶度積常數Ksp=1.1×10-36。室溫時在FeCl3溶液中滴加NaOH溶液,當溶液中Fe3+沉淀完全時,控制pH應不小于 。
(提示:當某離子濃度小于10-5 mol•L-1時可以認為該離子沉淀完全了;lg1.1×10-36=-35.96)
查看答案和解析>>
科目:高中化學 來源:2011-2012學年湖南益陽箴言中學高二下學期期末考試理科化學試卷(帶解析) 題型:填空題
食鹽中的抗結劑是亞鐵氰化鉀,其化學式為K4[Fe(CN)6] ?3H2O。
42.2g K4[Fe(CN)6] ?3H2O樣品受熱脫水過程的熱重曲線(樣品質量隨溫度的變化曲線)如下圖所示。試回答下列問題: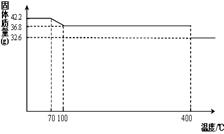
(1)試確定150℃時固體物質的化學式為_______________。
(2)查閱資料知:雖然亞鐵氰化鉀自身毒性很低,但其水溶液與酸反應放出極毒的氰化氫(HCN)氣體;亞鐵氰化鉀加熱至一定溫度時能分解產生氰化鉀(KCN)。據此判斷,烹飪食品時應注意的問題為___________________________________。
(3)在25℃下,將a mol?L-1的KCN(pH>7)溶液與0.01mol?L-1的鹽酸等體積混合,反應平衡時,測得溶液pH=7,則KCN溶液的物質的量濃度a_______0.01mol?L-1(填“>”、“<”或“=”)。
(4)在25℃下,KCN溶液pH=9,c(K+)-c(CN_)="_______" mol?L-1(用數字表示但不需近似計算)。
(5)已知Fe(OH)3的溶度積常數Ksp=1.1×10-38。室溫時在FeCl3溶液中滴加NaOH溶液,當溶液中Fe3+沉淀完全時,控制pH應不小于 。
(提示:當某離子濃度小于10-5 mol?L-1時可以認為該離子沉淀完全了;)
查看答案和解析>>
科目:高中化學 來源:2011-2012學年陜西省高三第11次模擬考試理綜化學試卷(解析版) 題型:填空題
(14分)食鹽中的抗結劑是亞鐵氰化鉀,其化學式為K4[Fe(CN)6] •3H2O。
42.2g K4[Fe(CN)6] •3H2O樣品受熱脫水過程的熱重曲線(樣品質量隨溫度的變化曲線)如下圖所示。
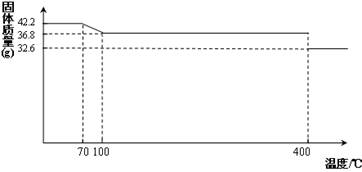
試回答下列問題:
(1)試確定150℃時固體物質的化學式為_______________。
(2)查閱資料知:雖然亞鐵氰化鉀自身毒性很低,但其水溶液與酸反應放出極毒的氰化氫(HCN)氣體;亞鐵氰化鉀加熱至一定溫度時能分解產生氰化鉀(KCN)。據此判斷,烹飪食品時應注意的問題為___________________________________。
(3)在25℃下,將a mol•L-1的KCN(pH>7)溶液與0.01mol•L-1的鹽酸等體積混合,反應平衡時,測得溶液pH=7,則KCN溶液的物質的量濃度a_______0.01mol•L-1(填“>”、“<”或“=”);用含a的代數式表示HCN的電離常數Ka=______________。
(4)在Fe2+、Fe3+的催化作用下,可實現2SO2+O2+2H2O=2H2SO4的轉化。已知,含SO2的廢氣通入Fe2+、Fe3+的溶液時,其中一個反應的離子方程式為4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,則另一反應的離子方程式為 。則上述轉化的重要意義在于 。
(5)已知Fe(OH)3的溶度積常數Ksp=1.1×10-36。室溫時在FeCl3溶液中滴加NaOH溶液,當溶液中Fe3+沉淀完全時,控制pH應不小于 。
(提示:當某離子濃度小于10-5 mol•L-1時可以認為該離子沉淀完全了;lg1.1×10-36=-35.96)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com