
【題目】研究NOx、CO等大氣污染氣體的處理及利用的方法具有重要意義,可實現綠色環保、節能減排、廢物利用等目的。
(1) 利用甲烷催化還原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJmol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1
甲烷直接將NO2還原為N2的熱化學方程式為 。
(2)已知等體積的一氧化碳和水蒸氣進入反應器時,發生如下反應:CO(g)+H2O(g) ![]() H2(g)+CO2(g),500℃時的平衡常數為9,若在該溫度下進行,設起始時CO和H2O的起始濃度均為0.020 mol·L-1,則CO的平衡轉化率為: 。
H2(g)+CO2(g),500℃時的平衡常數為9,若在該溫度下進行,設起始時CO和H2O的起始濃度均為0.020 mol·L-1,則CO的平衡轉化率為: 。
(3) 用活化后的V2O5作催化劑,氨氣將NO還原成N2的一種反應歷程如圖1所示。
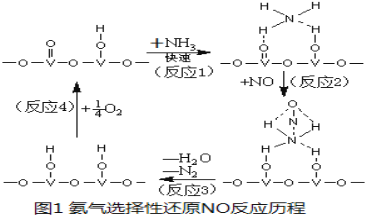
①寫出總反應化學方程式 。
②測得該反應的平衡常數與溫度的關系為:lgK=5.08+217.5/T,該反應是 反應(填“吸熱”或“放熱”)。
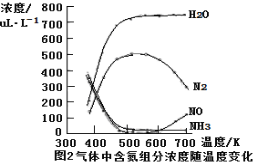
③該反應的含氮氣體組分隨溫度變化如圖2所示,當溫度達到700K時,發生副反應的化學方程式 。
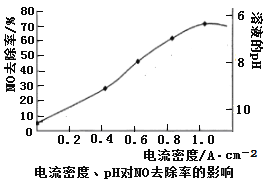
(4)下圖是用食鹽水做電解液電解煙氣脫氮的一種原理圖,NO被陽極產生的氧化性物質氧化為NO3—,尾氣經氫氧化鈉溶液吸收后排入空氣。如下圖,電流密度和溶液pH對煙氣脫硝的影響。
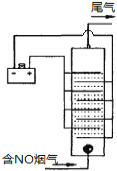
①NO被陽極產生的氧化性物質氧化為NO3-反應的離子方程式 。
②溶液的pH對NO去除率影響的原因是 。
③若極板面積10cm2,實驗煙氣含NO 1.5%,流速為0.070L·s-1(氣體體積已折算成標準狀態,且煙氣中無其他氣體被氧化),法拉第常數為96500 C·mol-1,測得電流密度為1.0 A·cm-2。列式計算實驗中NO除去率 。
【答案】(1) CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867 kJ·mol-1(2分)
(2) 75%(2分) (3) ①4NH3+4NO+O2![]() 4N2+6H2O (2分) ② 放熱 (1分)
4N2+6H2O (2分) ② 放熱 (1分)
③4NH3+5O2 ![]() 4NO+6H2O;(2分)(4) ①3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O(2分)
4NO+6H2O;(2分)(4) ①3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O(2分)
②次氯酸鈉在酸性條件下氧化性增強(1分)③ (2分)
(2分)
【解析】
試題分析:(1)已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJmol﹣1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1
根據蓋斯定律可知(①+②)÷2即得到甲烷直接將NO2還原為N2的熱化學方程式為
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867 kJ·mol-1。
(2) CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始濃度(mol/L) 0.02 0.02 0 0
轉化濃度(mol/L) c c c c
平衡濃度(mol/L)0.02-c 0.02-c c c
則根據平衡常數可知![]()
解得c=0.015
所以CO的轉化率是![]() ×100%=75%
×100%=75%
(3)①用V2O5作催化劑,NH3可將NO還原成N2,結合反應歷程圖可知反應物還有氧氣,生成物為N2和H2O,配平即得反應方程式為4NH3+4NO+O2![]() 4N2+6H2O。
4N2+6H2O。
②測得該反應的平衡常數與溫度的關系為:lgK=5.08+217.5/T,這說明升高溫度K值減小,因此反應向逆反應方向進行,所以該反應是放熱反應。
③根據圖像可知當溫度達到700K時氮氣的含量降低,NO含量升高,這說明氨氣被氧氣氧化為NO和水,則發生副反應的化學方程式為4NH3+5O2 ![]() 4NO+6H2O。
4NO+6H2O。
(4)①惰性電極電解飽和食鹽水,陽極氯離子放電產生氯氣,則NO被陽極產生的氧化性物質氧化為NO3-反應的離子方程式為3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O。
②根據圖像可知pH越小,去除率越高,這是由于次氯酸鈉在酸性條件下氧化性增強,因此去除率升高。
③若極板面積10cm2,實驗煙氣含NO 1.5%,流速為0.070L·s-1(氣體體積已折算成標準狀態,且煙氣中無其他氣體被氧化),法拉第常數為96500 C·mol-1,測得電流密度為1.0 A·cm-2,反應中氮元素化合價從+2價升高到+5價,失去3個電子,因此實驗中NO除去率為 。
。


科目:高中化學 來源: 題型:
【題目】某溫度時,在容積為2L的密閉容器中,X、Y、Z三種物質的物質的量隨時間的變化曲線如圖所示。由圖中數據分析:
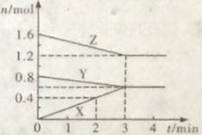
(1)該反應的化學方程式為: 。
(2)反應開始至2min末, X的反應速率為 。
(3)若要加快該反應的化學反應速率可以采取的措施有:增大物質濃度、加壓、 、使用正催化劑等。
(4)反應達到平衡狀態的起始時間為 min,平衡時Z的轉化率為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義。
(1)已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol
2NO(g)+O2(g) ![]() 2NO2(g) ΔH=-113.0 kJ/mol
2NO2(g) ΔH=-113.0 kJ/mol
則反應NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH=________ kJ/mol。
SO3(g)+NO(g)的ΔH=________ kJ/mol。
(2)一定條件下,將NO2與SO2以體積比1∶2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是________。
a.體系壓強保持不變 b.混合氣體顏色保持不變
c.SO3和NO的體積比保持不變 d.每消耗1 mol SO3的同時生成1 mol NO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現通過以下步驟由![]() 制備
制備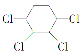
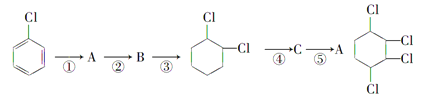
(1)寫出A、B的結構簡式:A:______________ B:______________。
(2)從左到右依次填寫每步反應所屬的反應類型(a.取代反應,b.加成反應,c.消去反應,只填字母代號): 。
(3)寫出④的反應方程式:
(4)寫出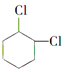 的含有六元碳環的同分異構體:
的含有六元碳環的同分異構體:
(5)寫出該制備方法的合成路線圖,有機合成路線圖示例如下:
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列3種有機化合物A: CH2=CH-CH3B:![]() C:CH3CH2OH
C:CH3CH2OH
(1)寫出化合物A、C中的官能團的名稱 、 。
(2)A在催化劑加熱條件下生成聚合物的反應方程式為 。
(3) B可以被酸性高錳酸鉀氧化成苯甲酸,寫出苯甲酸與C物質在濃硫酸中共熱發生酯化反應的化學方程式: 。
(4) 草酸(乙二酸)與乙二醇按1:1生成聚乙二酸乙二酯的反應方程式為__________。
(5) 苯酚鈉中通入二氧化碳的反應方程式為__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學——選修3物質結構與性質】
原子序數依次增大的四種元素A、B、C、D依次處于第一至第四周期,自然界中存在多種A的化合物,B原子核外電子有6種不同的運動狀態,B與C可形成正四面體形分子,D的基態原子的最外能層只有一個電子,其他能層均已充滿電子。
請回答下列問題:
(1)這四種元素中電負性最大的元素,其基態原子的價電子排布圖為 。
(2)C所在主族的四種元素分別與A形成的化合物,沸點由高到低的順序是 (填化學式),呈現如此遞變規律的原因是 。
(3)B元素可形成多種單質,一種晶體結構如圖一所示,其原子的雜化類型為 ,另一種的晶胞如圖二所示,用最簡式表示該晶胞的空間利用率 。
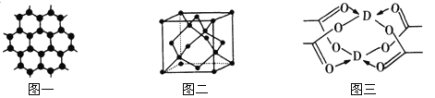
(4)D元素形成的單質,其晶胞內D原子的配位數為 ,D的醋酸鹽晶體局部結構如圖三,該晶體中含有的化學鍵是 (填選項序號)。
①極性鍵 ②非極性鍵 ③配位鍵 ④金屬鍵
(5)D元素形成的單質,既不溶于氨水也不溶于雙氧水,但溶于兩者的混合溶液。寫出該反應的離子方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學-選修2:化學與技術】
氯化亞銅(CuCl)廣泛應用于化工、印染、電鍍等行業。CuCl難溶于醇和水,可溶于氯離子濃度較大的體系,在潮濕空氣中易水解氧化。以海綿銅(主要成分是Cu和少量CuO)為原料采用硝酸銨氧化分解技術生產CuC1的工藝過程如下:
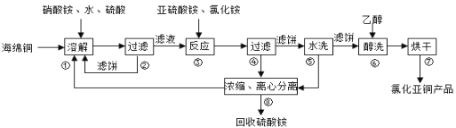
回答下列問題:
(1)步驟①中得到的氧化產物是___________,溶解溫度應控制在60-70℃,原因是___________;
(2)寫出步驟③中主要反應的離子方程式_________________;
(3)步驟⑤包括用pH=2的酸洗、水洗兩步操作,酸洗采用的酸是__________(寫名稱)。
(4)上述工藝中,步驟⑥不能省略,理由是_________________;
(5)步驟②、④、⑤、⑧都要進行固液分離.工業上常用的固液分離設備有_______(填字母)
A、分餾塔 B、離心機 C、反應釜 D、框式壓濾機
(6)準確稱取所制備的氯化亞銅樣品mg,將其置于過量的FeCl3溶液中,待樣品完全溶解后,加入適量稀硫酸,用amol/L-1的K2Cr2O7溶液滴定到終點,消耗K2Cr2O7溶液bmL,反應中Cr2O72-被還原為Cr3+,樣品中CuCl的質量分數為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F、G七種短周期元素,其原子序數依次增大。A的原子中沒有成對電子;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同;D原子最外層電子數是內層電子數的3倍;D與G處在同一族;F是地殼中含量最高的金屬元素。請回答下列問題:
(1)元素F在周期表中的位置 。
(2)B、C、D三種元素的第一電離能由大到小的順序是 (用元素符號表示)。
(3)配合物Ni(BD)4常溫下為液態,易溶于CCl4、苯等有機溶劑,因此固態Ni(BD)4屬于 (填晶體類型)。
(4)CA3分子的電子式為 。
(5)ED是優良的耐高溫材料,其晶體結構與NaCl晶體相似。ED的熔點比NaCl高,其原因是 。
(6)由A、D、G中任兩種元素構成甲、乙兩種均含18個電子的分子,所含原子的數目依次為3、4。則甲分子的中心原子采取 雜化;1 mol乙分子含有 molσ鍵。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化銨為原料,在活性炭催化下合成了橙黃色晶體X。為測定其組成,進行如下實驗。
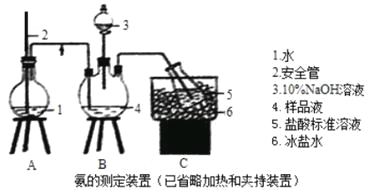
①氨的測定:精確稱取wgX,加適量水溶解,注入如圖所示的三頸瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸氣,將樣品溶液中的氨全部蒸出,用V1mLc1mol·L—1的鹽酸溶液吸收。蒸氨結束后取下接收瓶,用c2mol·L—1NaOH標準溶液滴定過剩的HCl,到終點時消耗V2mLNaOH溶液。
②氯的測定:準確稱取樣品X,配成溶液后用AgNO3標準溶液滴定,K2CrO4溶液為指示劑,至出現磚紅色沉淀不再消失為終點(Ag2CrO4為磚紅色)。
回答下列問題:
(1)裝置中安全管的作用原理是 。
(2)用NaOH標準溶液滴定過剩的HCl時,應使用 式滴定管,可使用的指示劑為 。
(3)樣品中氨的質量分數表達式為 。
(4)測定氨前應該對裝置進行氣密性檢驗,若氣密性不好測定結果將 (填“偏高”或“偏低”)。
(5)測定氯的過程中,使用棕色滴定管的原因是 ;滴定終點時,若溶液中c(Ag+)=2.0×10—5mol·L—1,c(CrO42—)為 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)經測定,樣品X中鈷、氨、氯的物質的量之比為1:6:3,鈷的化合價為 ,制備X的化學方程式為 ;X的制備過程中溫度不能過高的原因是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com