
【題目】硝酸鍶可用于制造煙火及信號彈等。工業級硝酸鍶![]() 含
含![]() 、
、![]() 等雜質
等雜質![]() 的提純流程如下。
的提純流程如下。![]() 已知:硝酸鍶、硝酸鋇不溶于濃硝酸
已知:硝酸鍶、硝酸鋇不溶于濃硝酸![]()
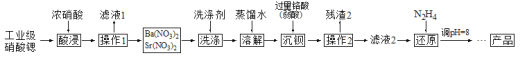
![]() 要加快“酸浸”速率所采取的措施是_________
要加快“酸浸”速率所采取的措施是_________![]() 寫一條即可
寫一條即可![]() 。
。
![]() 操作1的名稱是 _____________,洗滌所用的洗滌劑是 ________。
操作1的名稱是 _____________,洗滌所用的洗滌劑是 ________。
![]() “濾液2”中過量的
“濾液2”中過量的![]() 被
被![]() 還原為
還原為![]() ,同時放出無污染的氣體,寫出發生反應的離子方程式 _________;氧化產物與還原產物的物質的量之比為 _________。
,同時放出無污染的氣體,寫出發生反應的離子方程式 _________;氧化產物與還原產物的物質的量之比為 _________。
![]() 已知
已知![]() 不溶于水,還原后調節
不溶于水,還原后調節![]() 的目的是 ________。
的目的是 ________。
![]() 為了測定“殘渣2”中Cr元素的質量分數,進行以下實驗。
為了測定“殘渣2”中Cr元素的質量分數,進行以下實驗。![]() 已知:
已知:![]() 殘渣
殘渣![]()
![]() “殘渣2”中Cr元素的質量分數為 _______
“殘渣2”中Cr元素的質量分數為 _______![]() 用代數式表示
用代數式表示![]() 。
。
![]() 若加入的HI溶液過量太多,測定結果會是 ________
若加入的HI溶液過量太多,測定結果會是 ________![]() 填“偏高”、“偏低”或“無影響”
填“偏高”、“偏低”或“無影響”![]() ,其原因是 ______。
,其原因是 ______。
【答案】將工業級硝酸鍶磨得更細或不斷攪拌 過濾 濃硝酸 ![]() 3:4 除去
3:4 除去![]()
![]() 偏高 HI過量太多,過量
偏高 HI過量太多,過量![]() 會被空氣氧化成
會被空氣氧化成![]() ,過量的
,過量的![]() 要與
要與![]() 反應,消粍
反應,消粍![]() 的量増多
的量増多
【解析】
取含雜質的硝酸鍶樣品,向其中加入濃HNO3溶解,攪拌,過濾,“濾液1”的主要溶質是Ca(NO3)2,“濾渣1”的成分為Ba(NO3)2、Sr(NO3)2,并用濃HNO3洗滌濾渣,減少Sr(NO3)2溶解,進一步洗掉附著的Ca(NO3)2,將濾渣1溶于水中,加過量鉻酸使Ba2+沉淀,“濾渣2”的主要成分為BaCrO4,“濾液2”中過量的H2CrO4被N2H4還原為Cr3+,調節pH至7~8,Cr3+使轉化為Cr(OH)3沉淀,過濾分離,將濾液經過蒸發濃縮、冷卻結晶、過濾洗滌、干燥得產品,據此分析解析。
![]() 要加快“酸浸”速率所采取的措施是:將工業級硝酸鍶磨得更細或不斷攪拌;
要加快“酸浸”速率所采取的措施是:將工業級硝酸鍶磨得更細或不斷攪拌;
![]() 操作1的名稱是過濾,硝酸鍶、硝酸鋇不溶于濃硝酸,洗滌所用的洗滌劑是濃硝酸;
操作1的名稱是過濾,硝酸鍶、硝酸鋇不溶于濃硝酸,洗滌所用的洗滌劑是濃硝酸;
![]() “濾液2”中過量的
“濾液2”中過量的![]() 被
被![]() 還原為
還原為![]() ,同時放出無污染的氣體為氮氣,反應的離子方程式為:
,同時放出無污染的氣體為氮氣,反應的離子方程式為:![]() ,反應中鉻元素
,反應中鉻元素![]() 價變化為
價變化為![]() 價,電子轉移總數
價,電子轉移總數![]() ,得到還原產物
,得到還原產物![]() ,肼中氮元素化合價
,肼中氮元素化合價![]() 價變化為
價變化為![]() ,電子轉移總數
,電子轉移總數![]() ,得到氧化產物
,得到氧化產物![]() ,氧化產物與還原產物的物質的量之比為:3:4;
,氧化產物與還原產物的物質的量之比為:3:4;
![]() 已知
已知![]() 不溶于水,還原后調節
不溶于水,還原后調節![]() 的目的是除去
的目的是除去![]() ;
;
![]() 酸性條件下,
酸性條件下,![]() 與HI反應的離子方程式:
與HI反應的離子方程式:![]() ,
,![]() ,得到關系式:
,得到關系式:![]() ,則Cr3+的物質的量=
,則Cr3+的物質的量=![]() mol,“殘渣2”中Cr元素的質量分數
mol,“殘渣2”中Cr元素的質量分數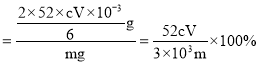 ;
;
![]() 若加入的HI溶液過量太多,部分HI被空氣中氧氣氧化成
若加入的HI溶液過量太多,部分HI被空氣中氧氣氧化成![]() ,過量的
,過量的![]() 要與
要與![]() 反應,消粍
反應,消粍![]() 的量増多,測定結果會是偏高。
的量増多,測定結果會是偏高。


科目:高中化學 來源: 題型:
【題目】黃酮醋酸(F)具有獨特抗癌活性,它的合成路線如下:

已知:RCN在酸性條件下發生水解反應: RCN ![]() RCOOH
RCOOH
(1)上述路線中A轉化為B的反應為取代反應,寫出該反應的化學方程式________。
(2)F分子中有3種含氧官能團,名稱分別為醚鍵、_____________和______________。
(3)E在酸性條件下水解的產物可通過縮聚反應生成高分子化合物,該高分子化合物的結構簡式為_________________________。一定條件
(4)寫出一種符合下列條件的D.的同分異構體的結構簡式________________。
①分子中有4種化學環境不同的氫原子
②可發生水解反應,且一種水解產物含有酚羥基,另一種水解產物含有醛基。
(5)對羥基苯乙酸乙酯(![]() )是一種重要的醫藥中間體。寫出以A和乙醇為主要原料制備對羥基苯乙酸乙酯的合成路線流程圖(無機試劑任選)。______________
)是一種重要的醫藥中間體。寫出以A和乙醇為主要原料制備對羥基苯乙酸乙酯的合成路線流程圖(無機試劑任選)。______________
合成路線流程圖請參考如下形式:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某三價鐵配合物的化學式可表示為Ka[Feb(C2O4)c]·xH2O,為測定其組成,進行如下實驗:
步驟1:稱取1.9640g該配合物晶體,配制成250.00mL溶液。
步驟2:取所配溶液25.00mL于錐形瓶中,加入1mol·L-1硫酸5.0mL,加熱到70~85℃,用0.0100mol·L-1KMnO4溶液滴定至終點,消耗KMnO4溶液48.00mL。
步驟3:向反應后的溶液中加入一定量鋅粉。加熱至黃色恰好消失,過濾,洗滌,將過濾及洗滌所得溶液收集到錐形瓶中,此時溶液仍呈酸性。
步驟4:繼續用0.0100mol·L-1KMnO4溶液滴定步驟3所得溶液至終點,消耗KMnO4溶液8.00mL。
(1)步驟2中,KMnO4將C2O![]() 氧化為CO2,該滴定反應的離子方程式為___。
氧化為CO2,該滴定反應的離子方程式為___。
(2)步驟3中黃色消失的原因是___(用離子方程式表示)。
(3)配制配合物溶液的過程中,若定容時俯視容量瓶的刻度線,則最終所得晶體組成中水的含量___(填“偏大”“偏小”或“無影響”)。
(4)通過計算確定該三價鐵配合物的化學式___(寫出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I. 用50 mL 0.50 mol·L-1鹽酸與50 mL 0.55 mol·L-1NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題:
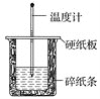
(1)從實驗裝置上看,圖中尚缺少的一種玻璃儀器是________。
(2)如果用60 mL 0.50 mol·L-1鹽酸與50 mL 0.55 mol·L-1NaOH溶液進行反應,與上述實驗相比,所求中和熱________(填“相等”或“不相等”)。
(3)實驗時所用鹽酸及NaOH溶液的體積均為50 mL,各溶液密度均為1 g·mL-1,生成溶液的比熱容c=4.18 J·g-1·℃-1,實驗起始溫度為t1℃,終止溫度為t2℃。試推斷中和熱的計算式ΔH=________。
(4)用相同濃度和體積的氨水代替NaOH溶液進行上述實驗,測得的中和熱的數值會________(填“偏大”、“偏小”或“無影響”)。
II.某研究性學習小組利用H2C2O4溶液和酸性KMnO4溶液的反應探究“外界條件的改變對化學反應速率的影響”,進行了如下實驗:
實驗序號 | 實驗溫度/K | 有關物質 | 溶液顏色褪至無色所需時間/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | VmL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通過實驗A、B,可探究出________(填外部因素)的改變對化學反應速率的影響,其中V1=________、T1=________;通過實驗________(填實驗序號)可探究出溫度變化對化學反應速率的影響,其中V2=________。
(2)若t1<8,則由此實驗可以得出的結論是________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硒![]() 與氧同主族,硒元素及其化合物與人體健康、工業生產密切相關。某科研小組以陽極泥
與氧同主族,硒元素及其化合物與人體健康、工業生產密切相關。某科研小組以陽極泥![]() 主要成分是Se,含有CuSe,
主要成分是Se,含有CuSe,![]() 等雜質
等雜質![]() 為原料,提煉硒的流程如下:
為原料,提煉硒的流程如下:
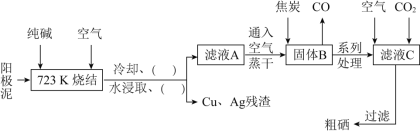
請回答下列問題:
![]() 硒原子的次外層電子數為________,與硒同周期相鄰元素是________
硒原子的次外層電子數為________,與硒同周期相鄰元素是________![]() 填元素名稱
填元素名稱![]() 。
。
![]() 已知濾液A中主要成分是
已知濾液A中主要成分是![]() ,可用于治療克山病,則
,可用于治療克山病,則![]() 的化學名稱為________;濾液C中主要成分是
的化學名稱為________;濾液C中主要成分是![]() ,則
,則![]() 的電子式為________。
的電子式為________。
![]() 上述流程圖中的括號內“
上述流程圖中的括號內“![]()
![]() ”,按操作先后順序依次填寫的內容是________、________。
”,按操作先后順序依次填寫的內容是________、________。
![]() 寫出高溫下用焦炭還原固體B的化學方程式________。
寫出高溫下用焦炭還原固體B的化學方程式________。
![]() 濾液C中析出硒的離子方程式為________。
濾液C中析出硒的離子方程式為________。
![]() 向
向![]() 溶液中滴加稍過量的乙酸,其離子方程式為________。已知:
溶液中滴加稍過量的乙酸,其離子方程式為________。已知:![]() 、
、![]() 、
、![]() 。
。
![]() 粗硒可采用真空蒸餾的方法進行提純,獲得純硒。真空蒸餾的揮發物中硒含量與溫度的關系如圖所示:
粗硒可采用真空蒸餾的方法進行提純,獲得純硒。真空蒸餾的揮發物中硒含量與溫度的關系如圖所示:
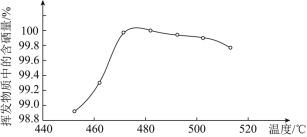
蒸餾操作中控制的最佳溫度是________![]() 填標號
填標號![]() 。
。
A ![]() B
B ![]() C
C ![]() D
D ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物G是合成某種耐熱聚合物的單體,其合成方法如下:
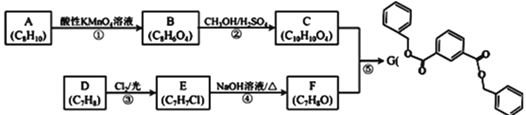
已知:R1COOR2+R3OH![]() R1COOR3+R2OH
R1COOR3+R2OH
![]() 中含氧官能團的名稱是 ______ ,F的名稱是 ______ 。
中含氧官能團的名稱是 ______ ,F的名稱是 ______ 。
![]() 上述流程中的取代反應除
上述流程中的取代反應除![]() 、
、![]() 外還有 ______
外還有 ______ ![]() 填序號
填序號![]() ,化合物E的核磁共振氫譜圖中共有 ______ 個吸收峰,峰面積比為 ______ 。
,化合物E的核磁共振氫譜圖中共有 ______ 個吸收峰,峰面積比為 ______ 。
![]() 按下列合成路線可得到F的同分異構體H,則可鑒別H與F的試劑是 ______ 。
按下列合成路線可得到F的同分異構體H,則可鑒別H與F的試劑是 ______ 。
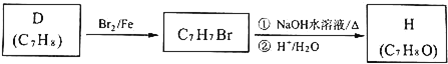
![]() 與NaOH溶液反應的化學方程式為 ______ 。
與NaOH溶液反應的化學方程式為 ______ 。
![]() 的同分異構體K具有如下性質:
的同分異構體K具有如下性質:![]() 能與NaOH溶液反應,且1molK完全反應消耗4molNaOH
能與NaOH溶液反應,且1molK完全反應消耗4molNaOH![]() 能發生銀鏡反應,且1molK與足量的銀氨溶液反應生成4molAg
能發生銀鏡反應,且1molK與足量的銀氨溶液反應生成4molAg![]() 分子中苯環上的一氯取代物只有一種。則K的結構簡式為 ______ 。
分子中苯環上的一氯取代物只有一種。則K的結構簡式為 ______ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳酸鋇是一種重要的無機鹽產品,廣泛應用于工業陶瓷、光學玻璃、建筑等行業。
![]() 生產制備:工業上一般以重晶石
生產制備:工業上一般以重晶石![]() 為原料,采用高溫煅燒還原法;實驗室一般以重晶石
為原料,采用高溫煅燒還原法;實驗室一般以重晶石![]() 為原料,采用沉淀轉化法。
為原料,采用沉淀轉化法。
高溫煅燒還原法:
![]()
![]() 煅燒還原的化學方程式為:_____________。
煅燒還原的化學方程式為:_____________。
![]() 為了提高浸取速率,可采取的措施是__________
為了提高浸取速率,可采取的措施是__________![]() 任寫一種
任寫一種![]() 。
。
![]() 經檢驗BaS的水溶液呈堿性,原因是
經檢驗BaS的水溶液呈堿性,原因是![]() 用離子方程式表示
用離子方程式表示![]() __________。
__________。
沉淀轉化法:向![]() 沉淀中加入飽和
沉淀中加入飽和![]() 溶液,充分攪拌,棄去上層清液。如此處理多次,直到
溶液,充分攪拌,棄去上層清液。如此處理多次,直到![]() 全部轉化為
全部轉化為![]() :
:![]() 平衡常數
平衡常數![]()
![]() 現有
現有![]() ,每次用
,每次用![]() 飽和
飽和![]() 溶液處理,假定
溶液處理,假定![]() 能全部轉化,至少需要處理_____________次。
能全部轉化,至少需要處理_____________次。
![]() 從“綠色化學”角度分析,用飽和
從“綠色化學”角度分析,用飽和![]() 溶液沉淀轉化法的優點是:__________。
溶液沉淀轉化法的優點是:__________。
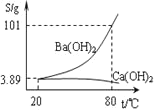
![]() 分離提純
分離提純
某實驗室分離提純混有少量碳酸鈣雜質的碳酸鋇樣品的步驟如下:
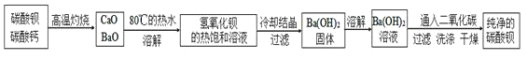
![]() 將灼燒后的固體混合物置于
將灼燒后的固體混合物置于![]() 的熱水中,制成氫氧化鋇的熱飽和溶液。為減少
的熱水中,制成氫氧化鋇的熱飽和溶液。為減少![]() 的損失并除去不溶物應進行的操作是_____。
的損失并除去不溶物應進行的操作是_____。
![]() 向制得的
向制得的![]() 溶液中滴加_______
溶液中滴加_______![]() 填一種試劑名稱
填一種試劑名稱![]() ,再通入二氧化碳。當觀察到_______時,即可停止通二氧化碳。
,再通入二氧化碳。當觀察到_______時,即可停止通二氧化碳。
![]() 環境監測
環境監測
![]() 環境監測某工廠廢水中
環境監測某工廠廢水中![]() 的濃度。取廢水
的濃度。取廢水![]() ,控制適當的酸度加入足量的
,控制適當的酸度加入足量的![]() 溶液,得
溶液,得![]() 沉淀;沉淀經洗滌、過濾后,用適量的稀鹽酸溶解,此時
沉淀;沉淀經洗滌、過濾后,用適量的稀鹽酸溶解,此時![]() 全部轉化為
全部轉化為![]() ,再加入過量KI溶液,反應液中再滴加
,再加入過量KI溶液,反應液中再滴加![]() 溶液,反應完全時,消耗
溶液,反應完全時,消耗![]() 溶液
溶液![]() 。已知有關的離子方程式為:
。已知有關的離子方程式為:![]() ;
;![]() 。
。
該工廠廢水中![]() 的物質的量濃度__________
的物質的量濃度__________![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上為了處理含有Cr2O![]() 酸性工業廢水,采用下面的處理方法:往工業廢水中加入適量的NaCl,以Fe為電極進行電解,經過一段時間,有Fe(OH)3和Cr(OH)3沉淀生成,經處理后的工業廢水中鉻(Cr)的含量已低于排放標準。請回答下列問題:
酸性工業廢水,采用下面的處理方法:往工業廢水中加入適量的NaCl,以Fe為電極進行電解,經過一段時間,有Fe(OH)3和Cr(OH)3沉淀生成,經處理后的工業廢水中鉻(Cr)的含量已低于排放標準。請回答下列問題:
(1)電極反應式:陽極___,陰極___。
(2)寫出Cr2O![]() 變為Cr3+的離子方程式___。
變為Cr3+的離子方程式___。
(3)工業廢水pH升高的原因___。
(4)該裝置中不能改用石墨電極,原因是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,則下列關于C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的說法正確的是( )
O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的說法正確的是( )
A.有10NA個電子轉移時,吸收1300 kJ能量
B.有8NA個碳氧共用電子對生成時,放出1300 kJ能量
C.有NA個水分子生成且為液體時,吸收1300 kJ能量
D.有2NA個碳氧雙鍵生成時,放出1300 kJ能量
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com